Traitement Parodontal Non Chirurgical / Parodontologie
Introduction
La parodontite résulte d’un déséquilibre entre la résistance de l’hôte et un environnement constitué d’un microbiote oral dysbiotique. Elle est considérée comme un problème majeur de santé publique, qui peut avoir des conséquences locales et systémiques sur l’état de santé général et la qualité de vie du patient. Le débridement non chirurgical reste la clé de voûte de tout traitement parodontal actif et de soutien. Il vise à stabiliser le niveau d’attache clinique, à limiter la perte des dents et à améliorer la qualité de vie liée à la santé bucco-dentaire.
Le traitement des maladies parodontales comporte plusieurs étapes :
- Le traitement étiologique : première étape incontournable du traitement parodontal.
- La réévaluation parodontale.
- Les thérapeutiques correctrices.
- La maintenance parodontale.
Le traitement parodontal non chirurgical (TPNC) représente une phase essentielle de la thérapeutique parodontale et restauratrice. Cette phase du traitement réduit l’inflammation clinique gingivale en éliminant les facteurs étiologiques locaux que sont la plaque dentaire et le tartre et est la première ligne “d’attaque” contre la maladie parodontale.
Maladies Parodontales
Les gingivites et les parodontites sont des pathologies inflammatoires chroniques, d’origine infectieuse, affectant les tissus de soutien de la dent. Elles sont généralement peu douloureuses et les patients viennent souvent consulter en raison de saignements gingivaux.
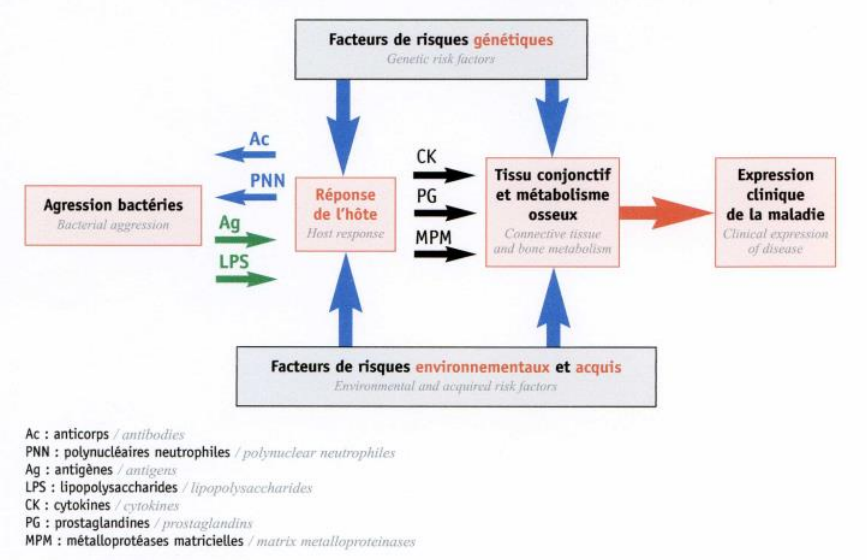
Figure 1 : Schéma étiopathogénique des maladies parodontales
(Page & Kornmann, 1997)
Démarche Diagnostique
Interrogatoire
- Impression générale.
- Antécédents généraux.
- Motif de la consultation.
- Antécédents dentaires : fréquence des visites, brossage dentaire.
Examen Buccal
- Hygiène buccale.
- Halitose.
- Salive.
- Lèvres.
- Muqueuse buccale.
- Langue.
- Palais.
- Région oropharyngée.
- Examen des dents.
- Examen de la relation interarcade.
- ATM (articulation temporo-mandibulaire).
Examen du Parodonte
- Gencive.
- Poche parodontale.
- Niveau d’attache.
- Exsudat et suppuration.
- Saignement.
- Furcations.
- Muqueuse alvéolaire.
Examens Complémentaires
- Techniques radiographiques avancées.
- Autres examens complémentaires.
Débridement Parodontal Non Chirurgical (DPNC)
Le contrôle de la charge bactérienne et la réduction des facteurs de risque parodontaux locaux, systémiques ou environnementaux, reposent essentiellement :
- Sur l’hygiène bucco-dentaire (HBD) quotidienne du patient.
- Et la prise en charge des facteurs de risque.
Une HBD insuffisante combinée à des facteurs de risque parodontaux non contrôlés est associée à l’échec du traitement et à la rechute de la maladie.
Le concept de débridement parodontal non chirurgical (DPNC) a émergé dans les années 80. Il consiste à éliminer la plaque sous-gingivale et les dépôts calcifiés et son objectif est de rendre la surface radiculaire biologiquement compatible pour favoriser la cicatrisation parodontale.
Le débridement parodontal non chirurgical (DPNC) est réalisé à l’aveugle sans qu’il soit possible de quantifier réellement la quantité l’élimination du biofilm. C’est pourquoi le succès du traitement est évalué par des signes cliniques : Gain d’attache clinique (GA) et la réduction de profondeur de poche (PP) et du saignement au sondage (BOP = Bleeding On Probing) qui témoignent de la résolution de l’inflammation.
Objectifs
- Éliminer les facteurs étiologiques de la parodontite : le biofilm, les toxines bactériennes et le tartre radiculaire.
- Réduire l’inflammation gingivale et le saignement.
- Remplacer la flore parodontopathogène par une flore compatible avec la santé parodontale.
- Assainir les poches parodontales et diminuer la profondeur de celles-ci.
- Obtenir une surface radiculaire lisse et bio compatible.
- Créer une nouvelle attache.
- Arrêter la progression de la maladie parodontale.
- Favoriser l’hygiène du patient.
Mesures d’Hygiène Orale
- Obtenir du patient une élimination régulière et suffisante du microbiote pour réduire l’inflammation, ce qui signifie une participation active du patient dans son traitement.
- Cette participation active ne peut être obtenue durablement qu’en lui donnant les explications nécessaires et adaptées.
- Nécessite des recommandations précises sur le matériel à utiliser, de lui montrer la façon de s’en servir et nous devons aider le patient à intégrer ces recommandations dans son quotidien.
Brosses à Dent Manuelle / Électrique
- Matériel adapté pour chaque patient, en fonction de la méthode de brossage proposée, pour concilier au mieux un traumatisme minimal sur les tissus mous et durs, efficacité à éliminer le microbiote et capacité réaliste du patient à utiliser le matériel recommandé en fonction de sa dextérité ou de sa motivation.
- Matériel doit comprendre une brosse adaptée ainsi que des moyens pour désorganiser le microbiote en interdentaire.
- Le choix entre brossage manuel ou électrique sera plutôt à adapter en fonction de la dextérité du patient, de sa motivation, de ses ressources financières ou encore de ses goûts.
- Plus que l’outil, c’est l’apprentissage de son utilisation qui prévaut.
- Choisir en fonction du morphotype parodontal plus ou moins fin et fragile, de la taille des embrasures, de la technique de brossage proposée et de son agressivité, de la « vigueur » du patient à appuyer fortement, une brosse suffisamment dure pour optimiser l’élimination du microbiote tout en évitant au maximum un brossage traumatique.
- Choix de la brosse à dent se portera le plus souvent vers des poils souples pour les méthodes de brossage plus agressives ou les patients ayant tendance à fortement appuyer sur la brosse.
- Brosse à dent électrique : privilégier des brins souples afin d’éviter toute lésion de la gencive et des tissus dentinaires exposés, ainsi que des têtes de taille réduite afin d’accéder en distal des dernières molaires ou dans les zones d’encombrement et de malpositions.
Surfaces Interdentaires
- Grande variété de dispositif pour désorganiser le microbiote en interdentaire. Ils sont par ordre d’efficacité les bâtonnets, le fil dentaire, l’hydropulseur et les brossettes interdentaires.
- À réserver les moins efficaces comme les bâtonnets aux patients les moins habiles pour les exercer dans un premier temps à introduire un accessoire dans leurs espaces interdentaires avant d’envisager l’utilisation de brossettes donnant de meilleurs résultats en terme de désorganisation du microbiote.
- Fil dentaire est plus difficile à manipuler que les brossettes et sera moins efficace que celles-ci. Son utilisation devra se limiter aux espaces où les brossettes ne peuvent pas passer sans trauma ou dans les espaces dont la hauteur entre le point de contact et la gencive marginale ne peut être accessible par les brins de la brossette.
- Accessoire de choix en terme d’efficacité pour la désorganisation du microbiote en interdentaire reste aujourd’hui la brossette interdentaire qui doit être calibrée en bouche.
Méthodes de Brossage
- Une attention particulière doit être donnée au brossage des faces difficiles d’accès ou souvent négligées lorsque le patient n’est pas suffisamment motivé, comme les faces distales des dernières molaires, en cas d’encombrement ou de malpositions ou encore les zones linguales des molaires mandibulaires.
- Accorder une attention toute particulière à la zone cervicale de toutes les dents.
- Méthode de Bass et ses versions modifiées – Méthode du rouleau – Méthode de Stillman.
- Adapter la technique enseignée à la technique « naturelle » employée par le patient.
- Amener un patient qui brosse :
- Verticalement vers la technique du rouleau.
- Horizontalement vers la technique de Bass.
- Avec un mouvement elliptique vers la technique de Bass modifiée.
Fréquence du Brossage Dentaire
- Brossage réalisé 2 fois par jour.
- Donner au patient des recommandations réalistes, compatibles avec l’engagement qu’il est prêt à fournir en fonction de ses habitudes en début de traitement.
Assainissement Parodontal
Détartrage – Surfaçage Radiculaire (DSR) (Débridement des Poches Parodontales)
Maintenir la santé parodontale en éliminant le biofilm et le tartre de la surface radiculaire reste l’objectif du traitement parodontal.
- Instruments manuels : curettes de Gracey, CK6, curettes diamantées.
- Ultrasons – Lasers à diode – Thérapie photodynamique.
Le détartrage : est l’acte qui permet d’éliminer les dépôts de plaque, de tartre et les colorations diverses au niveau des surfaces dentaires.
- Détartrage sus gingival : va permettre d’éliminer le tartre et le biofilm supra gingival qui se forme de manière continue à la surface des dents et de la gencive. Le patient peut réduire cette plaque en ayant une hygiène orale rigoureuse et régulière.
- Détartrage sous gingival : va supprimer le tartre présent dans le sulcus, non visible, qui est un facteur de rétention des bactéries pathogènes, mais il va aussi désorganiser le biofilm et ainsi réduire la charge bactérienne présente dans la poche. Une hygiène orale quotidienne ne supprime pas ce biofilm.
Indication : le DSR est indiqué pour tous les types de parodontite, qu’il soit associé ou non à un traitement antibiotique en fonction du diagnostic. Le détartrage constitue la démarche de base du traitement des gingivites et des parodontites. Il constitue le seul traitement dans les cas les plus simples de gingivite dans lesquelles il n’y a pas de perte d’attache.
Contre-indication : Sur le plan local, il n’en existe aucune tant que le pronostic de conservation dentaire n’est pas sans espoir. Sur le plan général, elles sont de deux ordres : liées à la bactériémie ou liées au saignement engendré par l’acte.
- Liées à la bactériémie : des prothèses valvulaires; un canal artériel; une cardiopathie congénitale cyanogène; une communication interventriculaire; des lésions intracardiaques traitées; une sténose aortique; des lésions valvulaires; des implants intracardiaques non valvulaires; une immunosupression (ex : syndrome de l’immunodéficience acquise [sida]); un diabète de type 1 non équilibré.
- Liées au saignement : une hémophilie ou trouble de l’hémostase, un patient sous anticoagulant avec un taux de prothrombine (TP) inférieur à 40%.
Surfaçage Radiculaire
Il correspond à l’acte qui permet d’éliminer les biofilms bactériens sous-gingivaux adhérents aux surfaces radiculaires. Le débridement définit l’acte qui permet d’éliminer les biofilms bactériens sous-gingivaux qui se sont formés au sein de la poche. En pratique, les 2 actes sont effectués en un seul geste. Lorsque ces termes sont employés conjointement (détartrage-surfaçage), ils définissent des actes non chirurgicaux réalisés à « l’aveugle » sans réclinaison de lambeau. Le débridement radiculaire se réalise en plusieurs séances, à raison d’une séance par semaine et par quadrant. Il faut donc 4 séances pour réaliser un assainissement mécanique complet du parodonte.
Indication :
- Le débridement radiculaire est indiqué pour toute parodontite, mais aussi en cas de gingivite hyperplasique ou d’abcès parodontal.
- Traitement suffisant dans les parodontites débutantes ou modérées qui révèlent de faibles pertes d’attache.
Dans tous les cas il est au moins présent en tant que thérapeutique initiale à un traitement chirurgical, en préparant les surfaces radiculaires et en diminuant l’inflammation.
Désinfection Globale (Full Mouth Disinfection)
La réinfection des sites déjà traités se fait par des germes pouvant provenir des sites parodontaux non traités, des amygdales, du dos de la langue, de la salive ou des muqueuses. Les germes incriminés sont Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis et Prevotella intermedia. Pour augmenter l’efficacité du traitement parodontal en évitant ou retardant une recontamination des sites traités, l’école belge (Quirynen et al, 1995) a proposé une nouvelle approche : réaliser le surfaçage complet de la bouche en 2 séances de 2 heures en 24 heures. Le traitement est complété par l’application de chlorhexidine en position supra et sous-gingivale.
Protocole :
- DSR : réalisé sous anesthésie locale par maxillaire à 24 heures d’intervalle.
- Chlorhexidine : utilisée sous différentes formes.
- Langue : brossée avec un gel à 1% pendant 60 secondes.
- Gorge : vaporisée avec un spray à 0,2%.
- Rinçage avec une solution à 0,2% : réalisé 2 fois pendant une minute.
- Toutes les poches : irriguées 3 fois 10 minutes avec un gel à 1% après chaque séance puis à J+8.
- Rinçage 2 fois/j pendant 60 secondes avec une solution à 0,2% : est réalisé pendant 14 jours.
Thérapeutiques Adjuvantes
Le DPNC vise à réduire l’inflammation parodontale locale et la charge bactérienne par la désorganisation du biofilm. Les résultats cliniques peuvent être améliorés lorsque ce traitement est associé à des thérapies adjuvantes :
- Antiseptiques.
- Antibiotiques.
- Laser.
- Thérapie photodynamique.
- Aéropolissage.
Antiseptiques – Antibiotiques
Antiseptiques (ATS)
De nombreux ATS ont été testés comme complément au DPNC : chlorhexidine, povidone iodée, peroxyde d’hydrogène, ammonium quaternaire, triclosan, huiles essentielles, hypochlorite de sodium ; avec différentes méthodes d’application (solutions, gels, systèmes à libération lente) et à différents moments du traitement.
Chlorhexidine (CHX) : bisbiguanide sous forme de digluconate active in vitro sur un large spectre de bactéries à Gram positif (Streptococcus sanguis, Actinomyces viscosus) et à Gram négatif, sur les levures, les champignons, les bactéries aérobies et anaérobies facultatives :
- Bactéricide à haute concentration (entre 0,12% et 0,2%) et bactériostatique à basse concentration (entre 0,02% et 0,06%).
- Activité inhibée par la présence de pus et de sang.
Effets secondaires :
- Colorations extrinsèques des dents, des restaurations et de la langue.
- Une diminution du goût aux aliments salés et sucrés (dysgueusie).
- Rares sensations de brûlures des muqueuses.
C’est un puissant agent antiplaque (gold standard).
Polyvidone-iodine (PVP-I) (Bétadine) : composée de 10% d’iode et d’un agent solubilisant (povidone). Elle a une activité bactéricide, toxique pour bactéries à Gram + et -, levures, mycobactéries, virus, protozoaires. Elle réduit le nombre de bactéries anaérobies : Aa et Pg pendant le 1er mois suivant son application. Utilisée comme solution d’irrigation pendant le débridement sous-gingival, elle réduit les poches profondes (>6 mm).
Effets secondaires indésirables :
- Coloration des surfaces dentaires et des muqueuses buccales.
- À éviter chez les patients allergiques à l’iode, la femme enceinte ou qui allaite, les patients présentant des dysfonctions thyroïdiennes.
Chlorure de cétylpyridinium (CPC) : composé d’ammonium quaternaire monocationique. Il est utilisé comme agent antimicrobien dans les bains de bouche et les dentifrices (réduire l’accumulation de plaque dentaire et l’inflammation gingivale).
Peroxyde d’hydrogène (H₂O₂) : la concentration la plus étudiée : 1,5%, sous forme de bain de bouche. Amélioration en ce qui concerne le contrôle de la plaque dentaire et la diminution bactérienne et de l’inflammation gingivale. Effet bactéricide sur les bactéries planctoniques et pourrait être utilisé comme prétraitement associé à la thérapie photodynamique antimicrobienne. À utiliser avec précaution car elle peut favoriser la dégradation des implants et des suprastructures en titane, entraînant la libération d’ions toxiques. À des concentrations élevées, il est retrouvé des effets délétères sur la muqueuse buccale.
Recommandations cliniques :
- En pré-thérapeutique : 0,2% CHX bain de bouche.
- Pendant le DPNC : irrigation avec povidone iodée ou CHX.
- En post-thérapeutique : antiseptiques en dentifrice et/ou bain de bouche.
Antibiotiques (ATB)
Certaines espèces bactériennes impliquées dans les MP ont la capacité d’envahir les tissus et, par conséquent, ne peuvent être éliminées par des thérapeutiques mécaniques comme le DPNC. Risque d’induire une résistance bactérienne et de déséquilibrer le microbiote oral.
Administration des ATB : soit localement sous forme de fibres, d’éponges, de gels, de microsphères, ou per os. Écosystème buccal comprend 700 à 800 espèces bactériennes différentes, ce qui rend difficile la recherche de l’antibiotique idéal.
Antibioprophylaxie (cf. ANSM 2011)
- Est recommandée selon le risque infectieux du patient et l’acte invasif pratiqué.
- Est instaurée pour limiter un risque d’endocardite infectieuse ou pour limiter un risque d’infection locale et son extension éventuelle.
- Son champ d’indication et sa durée de prescription ont été fortement réduits depuis les précédentes recommandations.
- Est recommandée, chez le patient à haut risque d’endocardite infectieuse, pour tout acte dentaire impliquant une manipulation de la gencive (par ex. le détartrage) ou de la région périapicale de la dent et en cas d’effraction de la muqueuse orale (exceptée l’anesthésie locale ou locorégionale).
Il convient de distinguer les patients :
- De la population générale, de loin les plus nombreux (absence d’immunodépression ou de cardiopathie à haut risque d’endocardite infectieuse).
- Immunodéprimés (après évaluation soigneuse avec les médecins concernés).
- À haut risque d’endocardite infectieuse (prothèse valvulaire, antécédent d’endocardite infectieuse, cardiopathie congénitale cyanogène).
Dorénavant, chez les patients présentant une cardiopathie à risque modérée : [autres valvulopathies : IA, IM, RA ; autres cardiopathies congénitales non cyanogènes, sauf communication interauriculaire (CIA) ; prolapsus de la valve mitrale (PVM) avec insuffisance mitrale et/ou épaississement valvulaire ; cardiomyopathie hypertrophique obstructive (avec souffle à l’auscultation)] et les patients porteurs d’une prothèse articulaire, l’antibiothérapie prophylactique n’est plus indiquée lorsqu’un geste bucco-dentaire est réalisé.
Cardiopathies à haut risque d’endocardite infectieuse (ANSM 2011)
- Prothèse valvulaire (mécanique ou bioprothèse) ou matériel étranger pour une chirurgie valvulaire conservatrice (anneau prothétique…).
- Antécédent d’endocardite infectieuse.
- Cardiopathie congénitale cyanogène :
- Non opérée ou dérivation chirurgicale pulmonaire-systémique.
- Opérée, mais présentant un shunt résiduel.
- Opérée avec mise en place d’un matériel prothétique par voie chirurgicale ou transcutanée, sans fuite résiduelle, seulement dans les 6 mois suivant la mise en place.
- Opérée avec mise en place d’un matériel prothétique par voie chirurgicale ou transcutanée avec shunt résiduel.
Actes non invasifs : Quel que soit le niveau de risque infectieux du patient, l’antibiothérapie prophylactique n’est pas indiquée pour la réalisation d’actes non invasifs, en particulier pour les actes listés ci-dessous (Grade C pour le patient à haut risque d’endocardite infectieuse, sinon Accord professionnel) :
- Actes de prévention non sanglants.
- Soins conservateurs.
- Soins prothétiques non sanglants.
- Dépose postopératoire de sutures.
- Pose de prothèses amovibles.
- Pose ou ajustement d’appareils orthodontiques.
- Prise de radiographies dentaires.
Antibiotiques Locaux
Petits effets bénéfiques sur la réduction des PP et le GA clinique à court terme seulement. Administrés sous forme de gels ou de fibres de tétracycline, de doxycycline ou de minocycline et doivent être réservés après réévaluation parodontale en cas de poches >4 mm avec BOP.
Antibiothérapie par Voie Systémique
Faible niveau de preuve des bénéfices d’une antibiothérapie adjuvante au DPNC, et surtout à un manque de preuve concernant la molécule la plus adaptée. En présence de nombreuses PP >4 mm avec BOP, ou chez les patients à haut risque d’infection : antibiothérapie nécessaire. Grande hétérogénéité des protocoles concernant les doses et la durée des traitements antibiotiques.
Prescription la plus efficace : amoxicilline (500 mg 3 fois/j) et métronidazole (soit 250 mg, soit 500 mg 3 fois/j ; elle ne devrait pas dépasser 7 jours afin d’assurer l’observance du patient et de réduire le risque de résistance bactérienne. Les quelques avantages des ATB ne doivent pas minimiser l’effet du TPNC et du contrôle des facteurs de risque du patient.
Utilisation des ATB locaux ou systémiques : dernières directives de l’EFP, pour le traitement des parodontites de stade I – III, les réservent à certains cas comme les parodontites généralisées de stade 3 chez le jeune.
Recommandations cliniques : pendant la phase active du traitement parodontal des parodontites sévères
Parodontites agressives – Parodontites chroniques avancées (classification Armitage 1999) : association amoxicilline-métronidazole, en complément du débridement sous gingival. Recommandé de prescrire 1,5 g d’amoxicilline en trois prises ou 2 g d’amoxicilline en deux prises associées à 1,5 g de métronidazole en deux ou trois prises pendant 7 jours. En cas d’allergie à l’amoxicilline, seul le métronidazole est prescrit à raison de 1,5 g par jour en trois prises pendant 7 jours (ANSM, 2011).
Laser (Light Amplification by Stimulated Emission of Radiation)
À la particularité d’émettre en phase des photons de même longueur d’onde et de même direction, ce qui leur donne une grande précision sur de longues distances. Effets thermiques (coagulation, vasodilatation), mécaniques (élimination des tissus durs) et biostimulants sur les tissus biologiques les rendent intéressants en dentisterie.
Lasers Er:YAG (Erbium:Yttrium-Aluminium-Grenat) : les plus utilisés en parodontologie. Rayonnement est absorbé préférentiellement par l’eau et la surface dentaire (adaptés comme thérapeutique adjuvante au DPNC ultrasonique).
Efficacité : réduction PP – GA clinique – Élimination du biofilm aussi efficace voire moins efficace que le DPNC.
Le laser présente plusieurs intérêts (Schwarz et coll., 2008) :
- Effets bactéricides envers les bactéries parodontopathogènes.
- Effets hémostatiques.
- Suppression sélective du tartre.
- Traitement en douceur pour le patient.
- Absence de gêne due aux vibrations.
- Diminution des besoins en anesthésie.
- Diminution des douleurs post opératoires.
Recommandation clinique : adjuvant au DPNC. Dernières directives de l uniting EFP pour le traitement des parodontites de stade I – III ne recommandent pas l’utilisation du laser comme adjuvant au DPNC.
Thérapie Photodynamique (TPD)
Elle fonctionne avec 3 composants :
- La lumière.
- Un composé photosensibilisateur mis en place, puis activé par des sources de lumière autres que des lasers comme des LED.
- L’oxygène.
Dans la thérapeutique parodontale, la TPD a été proposée comme approche complémentaire au débridement sous-gingival. Le bleu de toluidine 0 et le bleu de méthylène, qui sont capables de cibler directement les bactéries gram-négatives et gram-positives alors qu’ils n’ont pas d’effets cytotoxiques en soi, peuvent être utilisés comme sensibilisateurs. Utilisation des lasers à diodes pour activer le photosensibilisateur. Efficace sur Pg, Fn, Aa dans des biofilms artificiels.
Efficacité : GA
Dernières directives de l’EFP pour le traitement des parodontites de stade I – III ne recommandent pas l’adjonction de la TPD au débridement sous-gingival.
Aéropolissage
Décrit dans les années 80, le concept d’aéropolissage utilise de l’air sous pression, de l’eau et des poudres à granulométrie fine pour désorganiser les biofilms supra et sous-gingivaux.
Aéropolissage avec des poudres de bicarbonate de sodium : efficace et sûr pour éliminer le biofilm supra-gingival. Il ne convient pas pour le débridement sous-gingival en raison des dommages importants causés aux surfaces radiculaires et aux tissus mous.
Poudres faiblement abrasives :
- La glycine : acide aminé, inhibe l’activation des macrophages et réduit la production de radicaux libres.
- L’érythritol : chimiquement neutre, hydrosoluble et efficace sur Pg.
- Le tréhalose : très hydrosoluble et efficace sur les bactéries anaérobies Gram négatif.
Efficacité : suppression du biofilm sous-gingival > au débridement manuel ou ultrasonore. Adjuvant au DPNC en thérapeutique initiale. Seul en thérapeutique de soutien. Approche efficace pour la désorganisation du biofilm, rapide et confortable pour le patient.
Conclusion
Le DPNC à l’aide d’instruments manuels ou mécaniques reste la clé de voûte de la thérapeutique parodontale. De nos jours, le diagnostic de parodontite à l’aide de la classification selon les stades et les grades propose un traitement plus personnalisé et centré sur le patient, qui prend également en considération ses antécédents médicaux. La base du traitement parodontal (contrôle de la charge bactérienne et de l’inflammation) reste inchangée. Les lasers et la TPD présentent un intérêt considérable, mais ils ne peuvent pas encore remplacer le débridement parodontal classique en raison de l’hétérogénéité des études et semblent plus efficaces s’ils sont utilisés comme thérapeutiques adjuvantes.
L’utilisation des antiseptiques et des antibiotiques doit être plus raisonnée, l’utilisation d’antiseptiques ne permettant pas de suppléer une hygiène orale déficiente. Les prescriptions doivent impérativement faire l’objet d’une analyse bénéfice-risque plus poussée intégrant le risque inquiétant de création de résistances et le risque de dérèglement du microbiote gastro-intestinal du patient.
Références Bibliographiques
- AFSSAPS. Recommandations de bonne pratique : prescription des antibiotiques en pratique bucco-dentaire – Argumentaire, Saint-Denis. 2011.
- Brunnel-Trottebas S. La motivation et l’enseignement à l’hygiène bucco-dentaire chez le patient atteint de maladie parodontale. Clinic 2003; 24(4):223-228.
- Drisko CH. Non surgical periodontal therapy. Periodontol 2000 2001;5: 77-88.
- Fouque-Deruelle C, Monnet-Corti V. Le surfaçage radiculaire. Clinic 2003; 24(5):309-3313.
- Laffargue P, Soliveres S, Challot E, Jame F, Gibert P. Détartrage et surfaçage radiculaire. Encyclopédie Médico-Chirurgicale 23-445-E-12 (2004).
- Orti V, Jame O, Calas I, Gibert P. Antibiothérapie et maladies parodontales. Encyclopédie Médico-Chirurgicale 23-445-E-10 (2004).
- Perron B, Dalibard M et al. Le traitement parodontal non chirurgical. Questions-Réponses. JPIO 2020; 39: 70-82.
- Thomas C, Laurencin-Dalicieux S, Vinel A. Thérapeutiques adjuvantes et innovantes dans le traitement parodontal non chirurgical. Parodontologie Implantologie Orale Vol. 2-N°2 – Avril-Mai-Juin 2022.
- www.efp.org/newclassification.
Traitement Parodontal Non Chirurgical / Parodontologie
La santé bucco-dentaire est essentielle pour le bien-être général, nécessitant une formation rigoureuse et continue des dentistes. Les étudiants en médecine dentaire doivent maîtriser l’anatomie dentaire et les techniques de diagnostic pour exceller. Les praticiens doivent adopter les nouvelles technologies, comme la radiographie numérique, pour améliorer la précision des soins. La prévention, via l’éducation à l’hygiène buccale, reste la pierre angulaire de la pratique dentaire moderne. Les étudiants doivent se familiariser avec la gestion des urgences dentaires, comme les abcès ou les fractures dentaires. La collaboration interdisciplinaire avec d’autres professionnels de santé optimise la prise en charge des patients complexes. La santé bucco-dentaire est essentielle pour le bien-être général, nécessitant une formation rigoureuse et continue des dentistes.
Traitement Parodontal Non Chirurgical / Parodontologie

Dr J Dupont, chirurgien-dentiste spécialisé en implantologie, titulaire d’un DU de l’Université de Paris, offre des soins implantaires personnalisés avec expertise et technologies modernes.