OSTEITES DUES AUX BIPHOSPHONATES et AUX ANTI-RESORBEURS
OSTEITES DUES AUX BIPHOSPHONATES et AUX ANTI-RESORBEURS
Introduction
Les antiresorbeurs sont des médicaments qui agissent comme des agents inhibiteurs des ostéoclastes responsables de la résorption osseuse. Ceci est à l’origine de leur large utilisation depuis quelques années dans l’amélioration de la qualité de vie des patients atteints de pathologies osseuses bénignes et malignes. À côté de leur effet prouvé dans l’amélioration de la qualité de vie des patients, l’utilisation des antirésorbeurs a été reliée à l’apparition d’un effet secondaire majeur qui est l’ostéonécrose des maxillaires (ONM).
Historique
Les bisphosphonates, avant appelés diphosphonates, sont apparus en Allemagne vers la fin du 19ème siècle, plus précisément en 1865. Ils ont principalement été utilisés comme inhibiteurs de la corrosion dans l’industrie du textile et dans celle de l’huile. À partir des années 60, les bisphosphonates ont commencé à être utilisés dans le traitement de certaines pathologies du métabolisme osseux.
En 2003 (Marx et al), l’utilisation des bisphosphonates a été reliée, à la base de rapports de cas cliniques et d’études rétrospectives, à l’apparition d’un effet secondaire majeur qui est l’ostéonécrose des maxillaires. En 2005, l’AFSSAPS (Agence française de sécurité sanitaire des produits de santé) éditait une lettre d’information destinée aux praticiens susceptibles de prescrire des bisphosphonates (BPs) ou de devoir intervenir chirurgicalement sur des patients traités. En 2010, l’AFSSAPS et la MHRA (Medicines and Healthcare Products Regulatory Agency) ont communiqué sur la survenue de cas d’ONM chez des patients cancéreux traités par des antiangiogéniques.
Bisphosphonates (BPs)
Définitions
Les bisphosphonates (BPs) sont des analogues structuraux des pyrophosphates inorganiques ; ce sont des molécules synthétiques prescrites essentiellement pour diminuer la résorption osseuse.
Structure chimique des BPs
L’atome central d’oxygène de la liaison P-O-P du pyrophosphate inorganique est remplacé par un atome de carbone (liaison P-C-P), rendant la molécule de BPs résistante à l’hydrolyse enzymatique. Les radicaux R1 augmentent l’affinité des BPs pour l’hydroxyapatite. Les radicaux R2 déterminent la puissance.
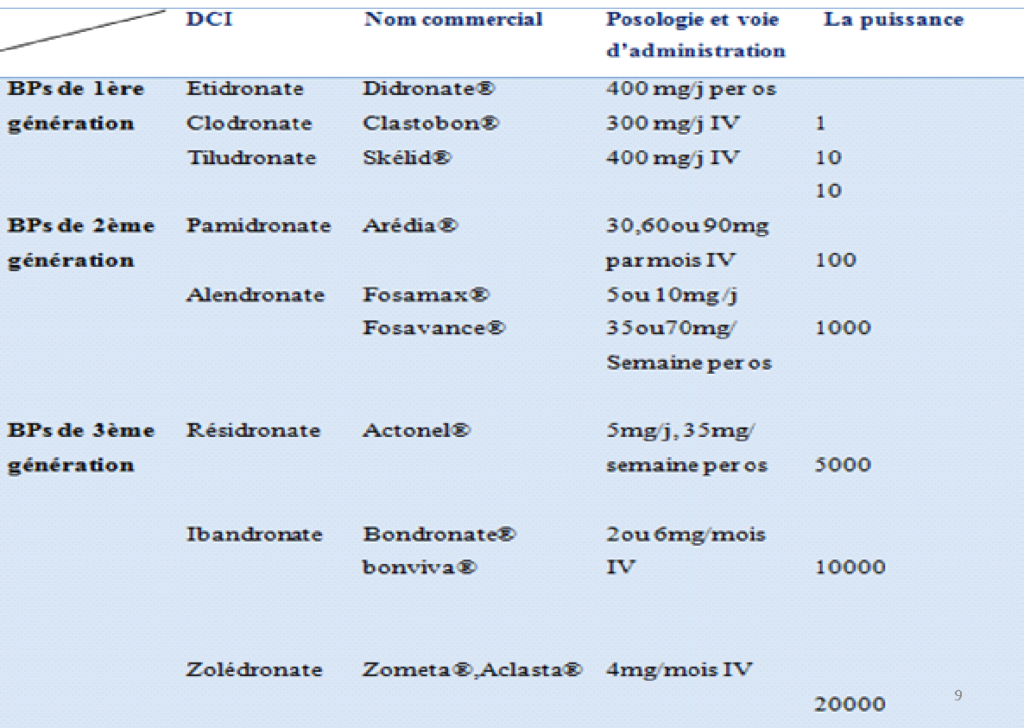
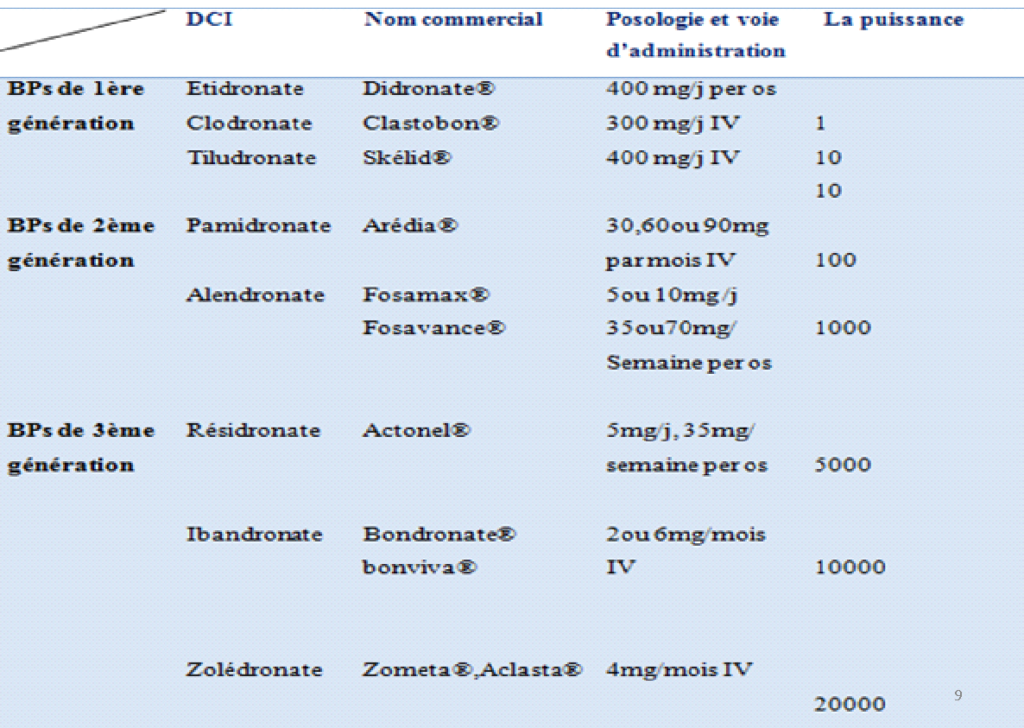
Classification des BPs
- BPs non aminés : de 1ère génération ; comportant CH, CH3 ou H en position R2, ils ne contiennent pas d’atome d’azote (clodronate, étidronate et tiludronate).
- BPs aminés : de 2ème et 3ème génération ; possèdent un atome d’azote dans leur radical R2 (alendronate, pamidronate, ibandronate, zolédronate).
Pharmacocinétique des BPs
Les BPs administrés par voie orale sont peu absorbés. Leur biodisponibilité varie de 1 à 5%. L’administration par voie intraveineuse assure une meilleure biodisponibilité (40 à 61%). La demi-vie plasmatique est courte, de l’ordre de quelques heures (6h). Par contre, leur demi-vie osseuse dure plusieurs années. L’élimination se fait par voie rénale.
Mécanisme d’action
C’est le résultat de deux propriétés chimiques principales :
- Affinité pour l’hydroxyapatite.
- Effet inhibiteur sur les ostéoclastes.
Mode d’action des BPs
- Inhibition de la calcification dans les tissus mous.
- Inhibition de la résorption osseuse.
- Autres effets :
- Action antiangiogénique : certains BPs (l’acide zolédronique).
- Effet pro-inflammatoire.
Indications
Pathologies malignes
- Myélomes multiples.
- Métastases ostéolytiques de certaines tumeurs malignes.
- Hypercalcémies malignes.
Pathologies bénignes
- Maladie de Paget.
- Ostéoporose (post-ménopausique ou masculine, cortico-induite).
- Syndrome de SAPHO.
- Nécrose aseptique de la hanche.
- Ostéogenèse imparfaite.
- Dysplasies fibreuses des os.
Effets indésirables
Effets indésirables à court terme
Ils sont bien connus et, pour la plupart, mineurs et transitoires :
- Nausée, vomissement, diarrhées, douleurs abdominales, anémie, thrombocytopénie, leucopénie, parfois pancytopénie, dysphagie, œsophagite, ulcères œsophagiens, syndrome pseudo-grippal et céphalées.
- Sécheresse et ulcération buccales, rares cas d’hypersensibilité immédiate et d’érythème polymorphe.
Effets indésirables à long terme
- Ostéonécrose des maxillaires.
Denosumab (Prolia®, Xgeva®)
Le denosumab, anticorps fabriqué en laboratoire par génie génétique, neutralise la protéine Rank-ligand, médiateur de la principale voie stimulant les différentes étapes de la différenciation des ostéoclastes, en bloquant leur formation. Le denosumab empêche la destruction du tissu osseux par ces cellules. Il agit donc sur le remodelage osseux mais, à la différence des BPs, il ne reste pas dans l’os et son action cesse rapidement une fois le traitement éliminé.
Antiangiogéniques : Sunitinib (Sutent®) et Bevacizumab (Avastin®)
Le sunitinib et le bevacizumab sont respectivement indiqués pour le traitement des cancers avancés non accessibles à une résection chirurgicale et pour le traitement des cancers métastatiques du colon, rectum, pancréas, sein, poumon et rein.
Ostéonécrose des maxillaires (ONM)
Définition de l’ostéonécrose des maxillaires (ONM) et (BRONJ) en anglais Bisphosphonates-Related Osteonecrosis of the Jaw
L’AFSSAPS définit l’ONM de la manière suivante :
- Traitement par BPs antérieur ou en cours.
- Lésion de la muqueuse au niveau de la région maxillo-faciale mettant à nu l’os nécrosé, persistant depuis plus de 8 semaines.
- Absence d’antécédents de radiothérapie dans la région maxillaire.
- Absence de localisation métastatique au niveau de la zone d’ONM.
Physiopathologie
- La fixation des BPs sur les cristaux d’hydroxyapatite osseux est proportionnelle à l’intensité du remodelage de l’os au moment de leur administration.
- Leur concentration est donc plus élevée dans les zones de croissance, les sites osseux en cours de cicatrisation, les sites tumoraux et ceux qui présentent naturellement un taux de remodelage physiologique plus important, comme l’os alvéolaire des maxillaires.
- Au niveau des maxillaires, le remodelage est important par les sollicitations constantes par les fonctions et parafonctions comme la mastication et les sollicitations musculaires lors de l’élocution, la mimique, le bruxisme, ce qui expliquerait les localisations des ostéonécroses au niveau maxillaire et mandibulaire.
Théories explicatives
Théorie d’hypocellularité
Les BPs induisent une apoptose des cellules osseuses, les ostéoclastes surtout. Il existe également un effet potentiel des BPs sur les ostéocytes et les ostéoblastes, ce qui est à l’origine d’une diminution du remodelage osseux dans les zones de fortes concentrations en BPs.
Théorie de l’hypovascularisation
L’effet antiangiogénique de certains BPs (zolédronate, pamidronate) entraîne une diminution de la vascularisation intra-osseuse.
Théorie de la toxicité directe des BPs
L’accumulation des BPs au niveau des maxillaires est directement toxique pour la muqueuse sus-jacente. Tout traumatisme (avulsion dentaire, irritation prothétique, etc.) provoquerait une augmentation de la concentration locale en BPs, responsable de l’échec de la cicatrisation des tissus mous et favorisant la surinfection et la nécrose osseuse.
Théorie des micro-fractures
Un traitement aux BPs fortement dosé pourrait conduire à un os « gelé » dont le remodelage est inhibé de façon trop importante. Cet os inerte a perdu toute capacité de réparation des micro-fractures physiologiques induites par la fonction (zolédronate, pamidronate et alendronate).
Théorie infectieuse
Dans la cavité buccale, les maxillaires sont soumis, lors de la fonction (mastication) et des parafonctions (bruxisme), à un stress régulier qui stimulerait l’activité de remodelage, entraînant une absorption plus importante des BPs. Cette accumulation de BPs pourrait induire une réduction drastique du remodelage, favorisant la nécrose osseuse. Dès lors, la vascularisation de la muqueuse sus-jacente est réduite et tout traumatisme mineur pourrait entraîner une exposition de l’os nécrosé sous-jacent. La colonisation secondaire par la flore buccale de l’os nécrosé exposé peut être responsable de douleurs ou d’accidents infectieux souvent révélateurs de l’ostéonécrose.
Étude clinique
Classifications
On décrit trois stades successifs :
- Stade I : Simple exposition osseuse asymptomatique avec tissus périphériques normaux.
- Stade II : Exposition d’os infecté associé à des symptômes fonctionnels et inflammation des tissus périphériques.
- Stade III : Fracture osseuse avec fistulisation extra-orale.
Basée sur l’échelle de la DOESAK :
- Stade 0 : Pas de symptômes d’os nécrotique avec exposition intra-orale.
- Stade I : Exposition intra-orale asymptomatique d’un os nécrotique ou petite fistule intrabuccale asymptomatique.
- Stade II : Exposition intra-orale d’os nécrotique associée à des douleurs et des symptômes d’infection concomitante.
- Stade III : Exposition intra-orale d’os nécrotique associée à des douleurs, tuméfaction et formation de cellulite (abcès), de multiples fistules et signes radiologiques d’ostéolyse étendue.
- Stade IV : Exposition intra-orale d’os nécrotique associée à des douleurs, tuméfaction et formation de cellulite (abcès), apparition d’une fistule extra-orale ou une fracture pathologique ou une communication bucco-sinusienne et signes radiologiques d’ostéolyse étendue au bord de la mandibule ou de larges parties du maxillaire.
Examen endobuccal
On retrouve une brèche muqueuse mettant à nu un os avasculaire et atone avec une ou plusieurs alvéoles dentaires déshabitées. La présence d’un séquestre osseux (responsable des douleurs) et l’inflammation de la gencive et des tissus mous périphériques. En cas de surinfection, il y a une suppuration avec fistule muqueuse et/ou cutanée. Des mobilités et pertes dentaires spontanées sont associées à ce tableau clinique. Les signes généraux sont exceptionnels.
L’aspect clinique de l’ONM associe des signes fonctionnels comme des douleurs d’intensité variable, lancinantes, non systématiques, une paresthésie ou anesthésie du territoire concerné (région labiomentonnière), une halitose, une cacosmie (localisation maxillaire avec répercussion sinusienne).
Aspects radiologiques
Orthopantomogramme/Rétroalvéolaire
Les signes radiologiques d’une ONM sont absents en début d’évolution même si l’ONM est visible cliniquement ; il faut une perte de 30% à 50% de la phase minérale osseuse pour qu’une ONM soit détectée. Dans les cas avancés, on note une séquestration au sein d’un environnement d’ostéodensification radiologique.
Tomodensitométrie (TDM)
Permet d’individualiser l’os cortical de l’os spongieux, l’évaluation de l’étendue d’un éventuel séquestre osseux en formation, la prolifération périostée au niveau mandibulaire donne une image en double contour.
Imagerie par résonance magnétique (IRM)
Permet de préciser l’atteinte des tissus mous adjacents, des sinus et du canal mandibulaire. Elle permettrait également de détecter des ONM infracliniques.
CT-scanner
Permet de voir des images avant même l’apparition des signes cliniques.
Scintigraphie
Est positive chez les patients présentant une ONM clinique.
Examen histologique
L’analyse histologique n’est pas nécessaire au diagnostic mais permet d’éliminer d’autres pathologies, en particulier les métastases de cancer, et une atteinte tumorale. L’os nécrosé ne montre pas de signe de remodelage osseux, on retrouve un infiltrat inflammatoire lympho-plasmocytaire dense avec des polynucléaires neutrophiles dans les espaces médullaires. Dans la plupart des cas, on distingue une infection avec mise en évidence des germes de la flore buccale et parfois une infection à actinomycètes.
Examens biologiques
Bilan sanguin
FNS, VS, CRP ont un intérêt dans la surveillance, éventuellement dans le diagnostic différentiel.
Marqueurs du remodelage osseux
NTx urinaire
Un taux de cross-linked N-telopeptides of collagen I (NTx) urinaire est élevé de façon persistante chez un nombre important de patients pendant le traitement par bisphosphonates.
Télopeptide C-terminal (CTX)
Le marqueur biochimique sérologique le plus utilisé pour stratifier le risque d’ONM chez les utilisateurs de bisphosphonates est le télopeptide C-terminal (CTX) réticulé du collagène de type I. Lorsque le taux de renouvellement osseux augmente, les ostéoclastes dégradent le collagène de type I, ce qui a pour effet de libérer des molécules de CTX.
Facteurs de risque
Ils sont en rapport avec le traitement par BPs et les facteurs bucco-dentaires.
Molécule et voie d’administration
Les molécules administrées par IV sont plus responsables d’ONM que par voie orale. Les molécules les plus puissantes et à biodisponibilité élevée sont plus souvent à l’origine d’ONM (zolédronate, pamidronate par voie IV).
Durée de traitement et dose cumulée
Le risque cumulé passe en moyenne de 1% après 12 mois de traitement à 11% après 48 mois. L’exposition à la molécule (nombre de perfusions et nombre d’heures cumulées de perfusion) est directement corrélée au risque d’apparition d’une ONM.
Facteurs bucco-dentaires
Les procédures invasives intra-buccales ou les pathologies dento-parodontales sont retrouvées dans 50% à 85% dans le déclenchement d’une ONM.
Autres facteurs
La corticothérapie, les traitements anticancéreux (pas de preuve formelle).
Diagnostic
Diagnostic positif
Ce sont les critères énoncés dans la définition de l’ONM.
Diagnostic différentiel
Tous les autres types d’ostéites (ORN, ostéites secondaires chroniques et aiguës, ostéomyélites, ostéites primitives, ostéites cortico-induites) et une localisation primitive ou métastase d’un cancer.
Prise en charge thérapeutique
L’Agence Française de Sécurité Sanitaire des Produits de Santé (AFSSAPS), en 2007, en collaboration avec un groupe d’experts comprenant des cliniciens, des stomatologues, des chirurgiens maxillo-faciaux et des chirurgiens-dentistes, a élaboré des recommandations concernant la prise en charge bucco-dentaire des patients traités par BPs. Ces recommandations concernent trois situations :
- Patients candidats à un traitement par bisphosphonates.
- Patients traités par bisphosphonates sans évidence d’ostéonécrose.
- Patients atteints d’une ostéonécrose avérée.
L’ONM continue à évoluer même avec traitement.
Prévention
Mesures préventives avant traitement
- Bilan bucco-dentaire clinique et radiologique.
- Élimination des foyers infectieux avérés ou potentiels par extraction ou traitement conservateur.
- Assainissement parodontal (détartrage et hygiène buccale rigoureuse).
- Élimination de toutes causes possibles de traumatisme muqueux.
- Informer le patient des risques encourus et de son rôle dans la prévention de l’ONM.
- Après traitement : suivi clinique pour intercepter tout problème et gestion de la façon la moins invasive.
Patients candidats à un traitement par bisphosphonates
Chez les patients devant recevoir un BP dans le cadre de pathologies malignes
- Il est indispensable de réaliser un bilan bucco-dentaire : celui-ci sera pratiqué par un chirurgien-dentiste ou un stomatologue.
- De réaliser un bilan radiologique : le panoramique dentaire devra être complété par des clichés rétro-alvéolaires voire un dental scanner ou une TDM en cas de doute concernant un foyer infectieux.
- Il est préférable de ne débuter le traitement par BP, si l’état clinique du patient le permet, qu’une fois la situation dentaire assainie : il faut effectuer les soins dentaires nécessaires, éliminer tous les foyers infectieux, attendre la cicatrisation des muqueuses et, dans la mesure du possible, la cicatrisation osseuse complète (120 jours).
Chez les patients devant recevoir un BP dans le cadre d’une ostéoporose/maladie de Paget
- Il est recommandé d’effectuer un bilan bucco-dentaire, un suivi des soins dentaires nécessaires. Ces soins ne doivent pas retarder l’instauration du traitement par BP chez les patients à risque élevé de fractures.
Patients traités par bisphosphonates sans évidence d’ostéonécrose
Chez les patients recevant un bisphosphonate dans le cadre de pathologies malignes
- Il est indispensable de réaliser un suivi bucco-dentaire. Celui-ci sera pratiqué par un spécialiste tous les 4 mois et au moindre symptôme bucco-dentaire, en collaboration avec l’oncologue.
- Dépister et traiter les foyers infectieux par des gestes aussi peu agressifs que possible pour l’os, le parodonte et la muqueuse. Il convient de limiter les extractions aux dents non conservables (mobilité de stade 3 ou présence de foyer infectieux actif) sans arrêter le traitement par BP, sous anesthésie locale ou locorégionale, sans vasoconstricteur, sous traitement antibiotique la veille de l’extraction puis jusqu’à cicatrisation complète (évaluée cliniquement et radiologiquement).
- Régulariser la crête alvéolaire et suturer les berges de façon hermétique, envisager de confectionner une attelle parodontale pour stabiliser les dents dont la mobilité est de stade 1 à 2, plutôt qu’une extraction.
- Éviter l’extraction en présence d’une dent avec carie délabrante mais sans mobilité pathologique, en réalisant un traitement de racine (en coupant la couronne de la dent au ras de la gencive), et en reconstituant la dent avec les techniques conventionnelles en prenant la précaution de ne pas altérer les tissus environnants.
- Contre-indiquer les traitements parodontaux chirurgicaux.
- Contre-indiquer l’implantologie. En revanche, la présence d’implants déjà intégrés dans la structure osseuse n’augmente pas le risque d’ONM ; ils doivent être conservés.
Chez les patients recevant un bisphosphonate dans le cadre d’une ostéoporose/maladie de Paget
- Il est recommandé :
- De réaliser un suivi bucco-dentaire, au minimum une fois par an.
- D’effectuer les avulsions dentaires, lorsqu’elles sont nécessaires, sous traitement antibiotique et de façon la moins traumatisante possible.
- La chirurgie nécessaire sera réalisée en évitant de lever un ou des lambeaux d’épaisseur totale ; s’il existe des problèmes de fermeture de la plaie, on privilégiera un lambeau d’épaisseur partielle pour préserver au mieux la vascularisation de l’os sous-jacent.
- Les données actuellement disponibles ne permettent pas de considérer que la prise de BP pour une ostéoporose est une contre-indication à la mise en place d’un implant dentaire.
Protocoles d’extraction dentaire
- Arrêt ou non du traitement par BPs en discutant avec le médecin prescripteur.
- Bilan radiologique pour apprécier la sévérité de la nécrose et la présence de séquestres.
- Hygiène bucco-dentaire stricte.
- Traitement antalgique et antiseptique local (bain de bouche à chlorhexidine 0,1%) au stade 1.
- Sous traitement antibiotique 24h (AFSSAPS : Amoxicilline 2g/j) ou 48h (DOESAK : groupe scientifique allemand-autrichien-suisse de travail des tumeurs de la mandibule et de la région cervico-faciale ; préconise l’utilisation de Augmentin® ou, en cas d’allergie, la clindamycine) avant l’extraction, puis jusqu’à cicatrisation complète.
- Sous anesthésie locale ou locorégionale, sans vasoconstricteur.
- Éviter les anesthésies intra-ligamentaires, intra-septales et intra-osseuses.
- Extraction dentaire suivie d’une régularisation de crêtes et sutures hermétiques.
- Gouttière souple.
- Antibiothérapie post-opératoire : 7 à 14 jours.
- Alimentation liquide à molle.
- Rinçages quotidiens à la chlorhexidine à 0,2% en post-chirurgical.
- Ablation des fils de suture au bout de 10 à 14 jours.
- Dépose des prothèses pendant au moins 3 semaines.
Patients atteints d’une ostéonécrose avérée
- Prise en charge dans un service hospitalier de chirurgie maxillo-faciale, ORL ou odontologie.
- Bilan radiologique (OPT) pour apprécier l’importance de la nécrose et la présence éventuelle d’un séquestre.
- Éviter tout geste chirurgical.
- Traiter médicalement la douleur.
- Hygiène bucco-dentaire stricte : rinçages quotidiens avec une solution antiseptique (chlorhexidine aqueuse à 0,1%) devant des ulcérations avec zone d’os nécrotique visible en bouche.
- Traitement chirurgical à minima (chirurgie de propreté avec régularisation des bords traumatisants, élimination de séquestre mobile).
- En cas de fracture et nécrose osseuse importante de la mandibule, éviter les reconstructions par greffes osseuses libres ou pédiculées.
- Résection de l’os nécrotique au voisinage de la fracture et fixateur externe ou, mieux, plaque de reconstruction avec ancrages vissés le plus loin possible de la zone de nécrose.
Prise en charge des ostéonécroses maxillaires avérées
Traitement conservateur
- ONM limitée : antibiothérapie à large spectre au long cours (pénicillines, macrolides ou tétracycline) + rinçages antiseptiques pluriquotidiens + antalgiques amènent la guérison de la majorité des cas.
- Sinon, chirurgie à minima : régularisation des bords osseux traumatisants les tissus mous ou si symptomatologie douloureuse.
Traitement invasif
- Traitement médical + chirurgie permettent une fermeture muqueuse pérenne pour isoler l’os de la cavité buccale pour éviter les surinfections secondaires (résultats bons si chirurgie réalisée rapidement après l’apparition de l’ONM).
- Traitement conservateur au laser + chirurgie d’exérèse précoce.
Procédure de traitement de l’ONM avérée
- Débuter l’antibiothérapie préopératoire par Augmentin® ou, à défaut, à la clindamycine 48h avant chirurgie per os ou 24h avant en injection intraveineuse.
- Antibiothérapie postopératoire de 10 à 14 jours par voie IV si le patient est hospitalisé et per os si le malade est en ambulatoire.
- Section sous-périostée avec une large exposition du site chirurgical en cas d’anesthésie endo-trachéale.
- Excision complète manuelle ou électrique de l’ostéonécrose jusqu’à la détection macroscopique de points de saignement.
- Régularisation des crêtes osseuses aux fraises en diamant.
- Ostéosynthèse en accord avec la décision du chirurgien.
- Possibilité de fermeture de la plaie par lambeaux muqueux « à plusieurs couches » :
- Avec les tissus mous du plancher buccal pour les cas de perte de substance « en boîte » de la mandibule.
- Avec la boule graisseuse de Bichat en cas d’ouverture du sinus maxillaire.
- Sutures hermétiques par points séparés et gouttière de protection en silicone souple non compressive.
- Alimentation par sonde naso-gastrique pendant 3 à 5 jours pour les chirurgies étendues ; puis alimentation liquide et molle pendant 10 à 14 jours.
- Rinçages quotidiens par antiseptiques (chlorhexidine 0,2%) après chirurgie.
- Hospitalisation pendant au moins 7 jours.
- Ablation des fils de suture après 10 à 14 jours.
- Déposer la prothèse pendant au moins 3 semaines.
BPs et implantologie dentaire
Le risque d’ostéonécrose associé à la pose d’implants est faible, mais ne peut être totalement écarté, chez les patients traités pour une affection bénigne par des BPs oraux. L’implantologie est donc possible, néanmoins il est nécessaire d’évaluer rigoureusement le risque ; elle est également autorisée chez les patients atteints d’une ostéoporose et traités par des BPs intraveineux, il faut cependant informer le patient qu’à l’heure actuelle, aucune donnée ne permet d’en évaluer le risque. Le risque associé à la pose d’un implant est plus élevé, et la survenue d’ostéonécrose est plus rapide chez les patients traités par des BPs intraveineux pour une affection maligne. L’AFSSAPS considère que les implants dentaires sont formellement contre-indiqués chez les patients traités par BPs intraveineux.
Prise en charge des patients implantés ou candidats à l’implantation dentaire
Patients porteurs d’implants dentaires et candidats à un traitement par BPs
Les recommandations sont identiques à celles des patients ne portant pas d’implants dentaires. La présence d’implants déjà intégrés dans l’os n’augmente pas le risque d’ostéonécrose, leur dépose n’est donc pas nécessaire.
Patients sous BPs oraux et candidats à la pose d’implants
Le risque d’ostéonécrose est faible mais ne doit pas être négligé. Il augmente d’autant plus que la durée du traitement est supérieure à 2 ans. Le patient doit être informé des solutions alternatives à l’implantologie et des risques associés ; certaines recommandations suggèrent qu’une fiche de consentement éclairé doit être signée par le patient. Il faut contacter le médecin prescripteur afin de discuter du rapport bénéfice/risque de la chirurgie, d’adapter voire arrêter temporairement le traitement si nécessaire. Aucune donnée dans la littérature n’a établi de protocoles chirurgicaux pour la pose d’un implant chez un patient sous BPs oraux. Cependant, les organisations professionnelles recommandent de :
- Réaliser des mesures d’hygiène avant l’intervention.
- Prescrire des bains de bouche antiseptiques (chlorhexidine) avant et pendant les jours qui suivent l’intervention.
- Prescrire des antibiotiques la veille de l’intervention et jusqu’à la cicatrisation complète (Amoxicilline 2g/j ou Clindamycine 600mg/j).
- Commencer par un secteur localisé et attendre 2 mois avant l’intervention suivante lorsque les sites de chirurgies sont multiples, afin de ne pas exposer d’emblée le patient à une ostéonécrose étendue.
- Éviter les anesthésies intra-ligamentaires, intra-septales et intra-osseuses. Bien que discutée, aucune donnée validée ne contre-indique l’usage des vasoconstricteurs.
- Éviter de lever des lambeaux d’épaisseur totale.
- Régulariser les bords osseux tranchants.
- Suturer les berges sans tension et de façon hermétique.
- Réaliser un geste chirurgical le moins traumatique possible.
- Surveiller la cicatrisation et continuer les mesures d’hygiène.
- Suivre régulièrement le patient (2 fois par an minimum).
Patients sous BPs et porteurs d’implants dentaires
Plusieurs complications peuvent survenir :
- Péri-implantite : Une péri-implantite est susceptible d’augmenter le risque d’ONM, elle doit donc être traitée le plus rapidement possible. Des mesures non chirurgicales basées sur une approche mécanique la moins traumatique possible (curetage, désinfection de surface) et pharmacologique (antibiothérapie) avec un suivi toutes les 4 à 6 semaines sont à privilégier.
- Échec implantaire : En cas d’échec de ces mesures chirurgicales de révision, il faudra procéder à la dépose de l’implant. Les recommandations liées à la dépose de l’implant s’apparentent au protocole préconisé pour l’avulsion d’une dent.
- Ostéonécrose péri-implantaire : En cas d’ostéonécrose péri-implantaire, le traitement doit s’effectuer en milieu hospitalier et s’inspire de la prise en charge classique de l’ostéonécrose. Le but est de diminuer la douleur, l’infection des tissus mous, et de réduire la progression de la nécrose osseuse.
Conclusion
L’ostéonécrose des maxillaires est un effet secondaire sérieux du traitement par les bisphosphonates. En attendant l’élaboration d’un traitement précis de cette complication, la prévention reste la meilleure initiative. Elle passe par l’information des patients sur les risques du traitement et l’éducation à une bonne hygiène bucco-dentaire.
Voici une sélection de livres en français sur les prothèses dentaires:
- Prothèse Amovible Partielle : Clinique et Laboratoire
Collège National des Enseignants en Prothèses Odontologiques (CNEPO), Michel Ruquet, Bruno Tavernier - Traitements Prothétiques et Implantaires de l’Édenté Total 2.0
- Conception et Réalisation des Châssis en Prothèse Amovible Partielle
- Prothèses supra-implantaires: Données et conceptions actuelles
- Prothèse complète: Clinique et laboratoire Broché – Illustré, 12 octobre 2017
- Prothèse fixée, 2e Ed.: Approche clinique Relié – Illustré, 4 janvier 2024

Leave a Reply