Lésions Inflammatoires Périapicales d’Origine Endodontique (LIPOE) / OCE
Lésions Inflammatoires Périapicales d’Origine Endodontique (LIPOE) / OCE
Introduction
La lésion apicale ou lésion inflammatoire péri-radiculaire d’origine endodontique (LIPOE) est une des affections les plus courantes de la planète. Elle représente un problème de santé publique largement sous-estimé, faisant suite à une infection bactérienne de l’endodonte se diffusant à travers le foramen apical au périapex. L’étude de sa distribution montre des répartitions diverses et variées, en fonction des pays, et des méthodes d’investigation choisies. En 2002, une étude française a montré que plus de 66 % des patients étaient porteurs d’au moins une lésion apicale. Si l’on considère que les méthodes d’analyse et d’observation se fondaient sur la base d’examens radiographiques en deux dimensions, on mesure à l’heure du Cône Beam Computerized Tomography (CBCT) que ces chiffres seront revus à la hausse.
La santé bucco-dentaire est le miroir de la santé générale, c’est l’une des premières étapes de défense de l’organisme vis-à-vis des agressions extérieures. Chez les personnes à risque et en moins bonne santé cardiovasculaire, une infection buccodentaire non traitée peut entraîner des complications graves voire mortelles. Les bactéries dans la bouche sont beaucoup plus nocives entraînant des gingivites, une inflammation des artères aboutissant à des caillots sanguins constituant une base au développement d’athérosclérose et être ainsi à l’origine d’infarctus du myocarde, d’AVC ou de rupture d’anévrisme.
La maladie endodontique peut être un facteur de risque majeur pour les patients atteints d’une maladie cardiaque existante et peut augmenter le risque de développer une maladie cardiaque chez des patients en bonne santé. Diabète, mauvaise nutrition et tabagisme constituent un risque d’AVC ou d’IDM et est également fortement augmenté par une maladie endodontique. La relation étroite entre le péri-apex et la circulation systémique permet d’établir des liens avec l’état général. Ces liens sont de plus en plus étudiés et démontrés dans la littérature. Les LIPOE représentent une grande part de l’activité et des motifs de consultation en urgence des chirurgiens-dentistes.
Rappels sur la Cavité Endodontique et le Tiers Apical Radiculaire
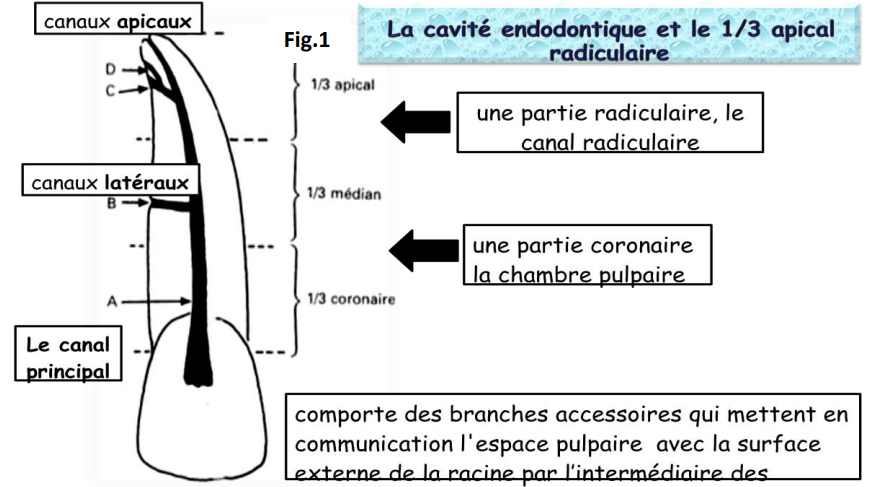
La cavité endodontique qui abrite la pulpe dentaire se divise en deux parties :
- Partie coronaire : chambre pulpaire
- Partie radiculaire : canal radiculaire
Le Tissu Périapical ou Péri-apex ou Parodonte Profond
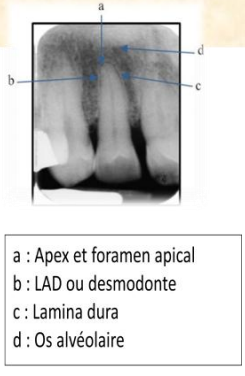
- L’os alvéolaire qui circonscrit l’alvéole où s’implante la dent.
- Le cément qui est un tissu minéralisé tapissant la racine dentaire.
- Le ligament parodontal, solidement amarré aux deux tissus durs, osseux et cémentaire.
Le péri-apex est le site de l’atteinte apicale :
- Apex : correspond à « l’apical vertex », c’est-à-dire le sommet du dôme constitué par l’extrémité de la racine.
- Constriction apicale : une zone de rétrécissement de la section du canal à une courte distance de son ouverture sur la surface radiculaire.
- Foramen apical : la limite entre le canal et la surface radiculaire ; il est rarement situé au niveau de l’apex.
- Jonction C-D : frontière entre l’endodonte et le parodonte.
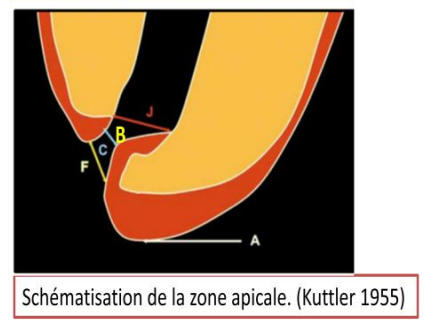
Schématisation de la Zone Apicale (Kuttler 1955)
- Apex et foramen apical
- LAD ou desmodonte
- Lamina dura
- Os alvéolaire
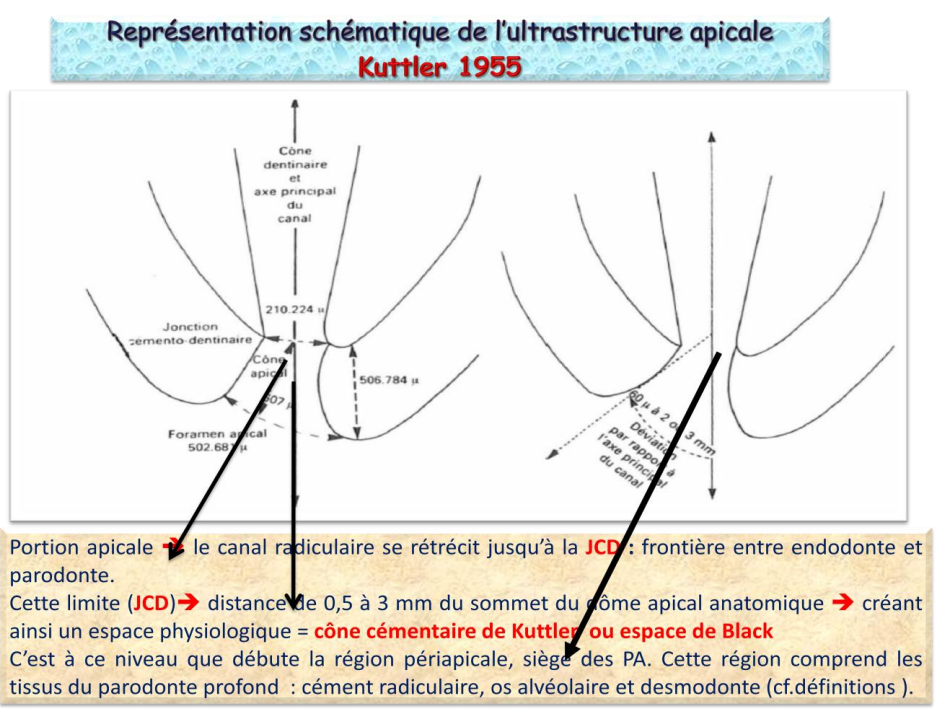
Représentation Schématique de l’Ultrastructure Apicale (Kuttler 1955)
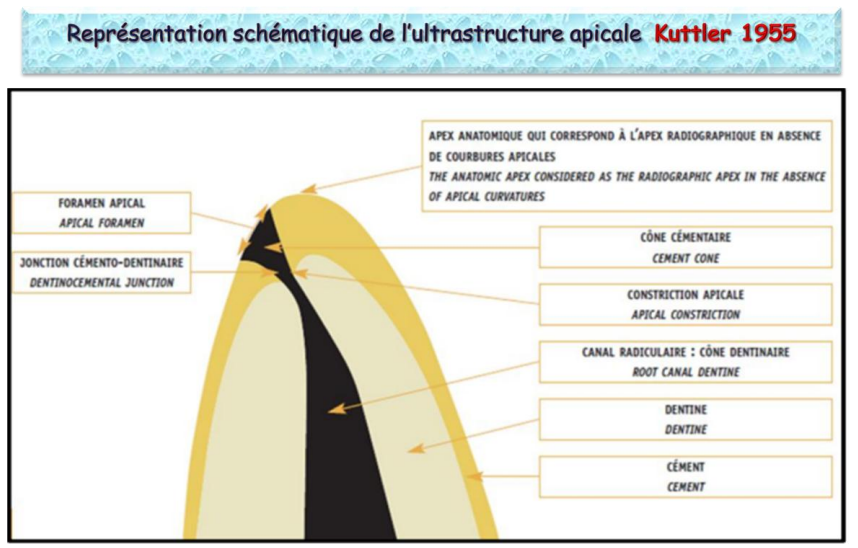
Dans sa portion apicale, le canal radiculaire se rétrécit jusqu’à la jonction cémento-dentinaire (JCD) qui marque la frontière entre l’endodonte et le parodonte. Cette limite se situe à une distance de 0,5 à 3 mm du sommet du dôme apical anatomique, créant ainsi un espace physiologique appelé cône cémentaire de Kuttler ou espace de Black. C’est à ce niveau que débute la région périapicale, siège des parodontites apicales. Cette région comprend les tissus du parodonte profond : cément radiculaire, os alvéolaire et desmodonte.
Kuttler a permis d’établir des précisions sur l’anatomie de cette région qui forme deux cônes :
- Cône dentinaire : dont le sommet se situe à la JCD et dont la base est cervicale.
- Cône cémentaire : inversé par rapport au premier, dont le sommet se situe à la JCD et dont la base correspond au foramen apical.
On y retrouve les constituants habituels du desmodonte situés entre le cément qui borde le foramen apical et le fond de l’alvéole osseux. Entre les trousseaux fibreux collagéniques, les espaces sont occupés par les éléments vasculo-nerveux et une riche population cellulaire hétérogène : fibroblastes, fibrocytes, cellules de défense, cellules indifférenciées, cellules du remaniement osseux, cémentoblastes et parfois des vestiges épithéliaux de Malassez entourés par la matrice extracellulaire.
- Jonction cémento-dentinaire (JCD) : marque la frontière entre l’endodonte et le parodonte au niveau apical, elle se situe à une distance de 0,5 à 3 mm du dôme apical anatomique.
- Cément apical : tissu conjonctif avasculaire et minéralisé qui se remanie dans la région apicale par apposition cémentaire continue.
- Desmodonte apical : caractérisé par sa forte capacité de remodelage et d’adaptation grâce à ses constituants fibrillaires de collagène cellulaire et la substance fondamentale.
Innervation du Desmodonte
L’innervation du desmodonte est supportée par des fibres myéliniques et amyéliniques et par des mécanorécepteurs. Une fois stimulée, elle induit la libération transitoire de SP et CGRP, au voisinage des parois osseuses et cémentaires, qui entrent en résorption.
Os Alvéolaire
L’os alvéolaire est une lame cribliforme permettant la connexion du desmodonte aux espaces médullaires de l’os spongieux des maxillaires.
Voies de Communications Endo-Parodontales
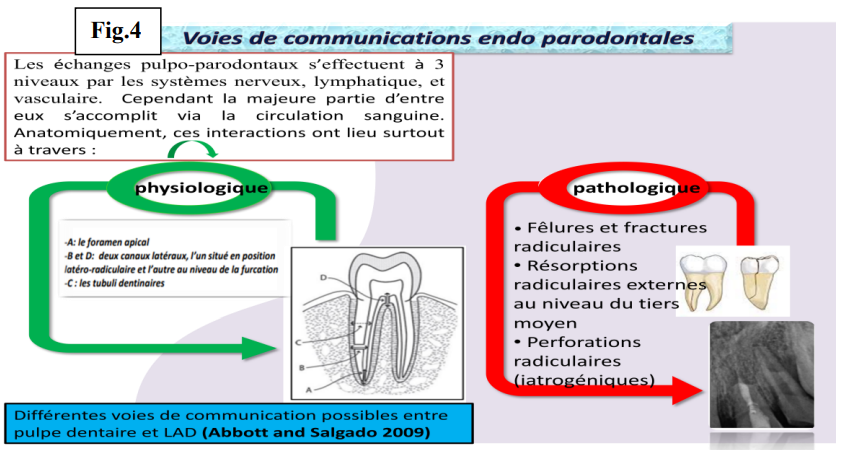
Les échanges pulpo-parodontaux s’effectuent à trois niveaux par les systèmes nerveux, lymphatique et vasculaire. Cependant, la majeure partie d’entre eux s’accomplit via la circulation sanguine.
Définition
Les pathologies péri-apicales sont des lésions de type inflammatoire affectant le parodonte profond (desmodonte et os alvéolaire), consécutives à une infection bactérienne de l’endodonte ou suite à une maladie parodontale. Le processus infectieux présent dans la pulpe s’étend vers la région du périapex, source d’irritation et d’inflammation, provoquant une réponse inflammatoire de défense des tissus périapicaux qui tend à circonscrire l’infection et à l’empêcher de diffuser dans l’organisme. Notons que ces lésions périradiculaires, qui le plus souvent ont une origine endodontique, peuvent aussi admettre une étiologie combinée avec la maladie parodontale (lésion endo-parodontale).
Terminologie
La terminologie de langue française actuellement retenue reprend le terme de Lésion Inflammatoire Péri-Radiculaire d’Origine Endodontique (LIPOE) pour décrire les manifestations parodontales associées à la pulpite aiguë ou secondaires à la nécrose pulpaire. La desmodontite, la parodontite apicale, le granulome apical ou le kyste odontogène sont donc des LIPOE qualifiées d’aiguës ou de chroniques selon leur évolution. L’abcès apical aigu constitue une entité distincte correspondant à une LIPOE aiguë purulente.
Épidémiologie
La prévalence des LIPOE est de 20 à 50 %. Les LIPOE affectent principalement les incisives supérieures, les premières prémolaires maxillaires et les premières molaires mandibulaires. Le risque des LIPOE augmente avec l’âge, d’environ 10 % à 20 ans jusqu’à 75 % à 70 ans.
Étiopathogénie
Étiologies
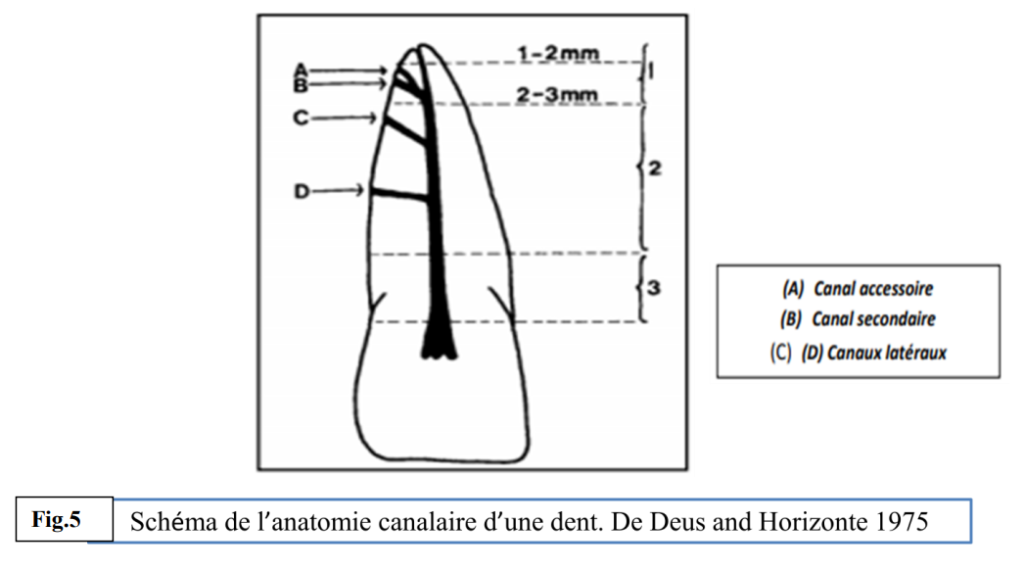
Les particularités de la région apicale rendent l’infection apicale encore plus complexe : isthme, déviation du cône cémentaire, paquet vasculo-nerveux, stimulation des immunoglobulines E, interface avec les tissus parodontaux. Plusieurs voies de contamination bactérienne peuvent être à l’origine des pulpopathies : les lésions carieuses ou d’usure, les poches parodontales qui exposent les canaux latéraux et accessoires le long de la racine ou de la furcation, les microfissures, les fêlures, les traumatismes exposant la pulpe, les matériaux non étanches ou non biocompatibles. Cela explique pourquoi les flores endodontiques et parodontales sont très proches.
Facteurs Généraux
- Via anachorèse : les barotraumatismes et états bactériémiques comme la grippe peuvent entraîner un réchauffement d’une réaction asymptomatique préexistante en parodontite apicale aiguë.
- Traumatisme sans fracture : mortification pulpaire aseptique, fixation de bactéries (par le sang) chez des sujets avec infection générale pyogène.
Facteurs Locaux : Infectieux, Physique et Chimique
- Via une exposition directe de la pulpe dans la cavité buccale : les bactéries peuvent envahir la pulpe en cas de caries, fractures, restaurations non étanches, abrasions, attritions.
- Via une infection parodontale : dès que la pulpe est nécrosée, les bactéries des poches parodontales peuvent atteindre les canalicules dentinaires via la multitude de ramifications qui peuvent assurer une communication endo-paro et mettre en place un processus infectieux.
- Via des anomalies congénitales : dents invaginées, défauts des sillons favorisent des expositions spontanées de la pulpe.
Infectieux
Comme à l’apex il n’existe pas de frontière entre la pulpe et le desmodonte, une inflammation pulpaire en phase extensive peut se propager aux tissus péri-apicaux et occasionner une réaction péri-apicale. Il peut se produire une association entre les différents facteurs locaux :
- Pulpite purulente totale, mais le plus souvent une gangrène pulpaire.
- Inoculation septique du desmodonte au cours des traitements radiculaires, en particulier celui de la gangrène pulpaire par propulsion de débris nécrotiques en direction apicale.
Remarque : Toutes les autres causes d’inoculation septique ne sont pas endodontogènes, qu’il s’agisse de la pénétration d’un corps étranger dans le desmodonte (piqûre par poil de brosse à dents, cure-dent ou arête de poisson, etc.), d’un bourrage alimentaire interdentaire (lésion du septum interdentaire).
Mécaniques
- Traumatismes : contusions, luxations, fêlure, exposition pulpaire directe => nécrose septique.
- Dépassement d’instrument : manœuvres opératoires brutales.
- Troubles de l’occlusion et de l’articulation : surocclusions, traumatismes occlusaux.
Chimiques
- Iatrogène/médicamenteux : irritation ou dépassement péri-apical de solutions d’irrigation (hypochlorite de sodium, EDTA, etc.). Toute substance utilisée dans ces traitements est susceptible de déterminer une inflammation si son application ou sa dose n’est pas respectée.
- Effets des matériaux d’obturation canalaire : les accidents thérapeutiques endodontiques de débordement de pâtes ou dépassement d’un cône de gutta à l’origine d’une desmodontite médicamenteuse.
- Dentisterie restauratrice mal conduite.
- Inoculation péri-apicale : sur-instrumentation.
- Échec du traitement endodontique : erreur de la longueur de travail, préparation canalaire insuffisante, instrument cassé.
Microbiologie
La flore endodontique responsable des LIPOE est une flore poly-microbienne composée de bactéries anaérobies, strictes et facultatives, parmi lesquelles prédominent des bactéries anaérobies strictes et facultatives, notamment les bâtonnets Gram- : Fusobacterium nucleatum vincentii, Prevotella, et les cocci Gram+ du type Peptostreptococcus. Les flores endodontiques et parodontales sont très proches. Trois bactéries sont présentes dans 90 % des infections endodontiques : Bacteroides forsythus, Campylobacter et Fusobacterium nucleatum vincentii.
Dans le cas des dents cariées, la flore canalaire reflète la flore d’origine salivaire telle que les staphylocoques, Neisseria, Lactobacillus, etc. Puis, le rapport germes aérobies-anaérobies s’inverse au cours du temps et la flore devient en 6 mois exclusivement anaérobie dans une dent nécrosée, non traitée et porteuse d’une lésion apicale. Dans les canaux infectés fermés, il y a plus de 90 % de germes anaérobies stricts et environ 70 % dans d’autres cas.
La microflore des canaux au niveau desquels le traitement endodontique a échoué est différente, on trouve surtout les bactéries Gram+ de type Enterococcus faecalis, Actinomyces, Propionibacterium acnes et Candida albicans. Ces microorganismes vont s’organiser en biofilm péri-apical en sécrétant une couche de polysaccharides, résistant aux antibiotiques mais aussi aux produits d’irrigation et aux défenses de l’hôte. Avec le temps, le statut du canal évolue vers la mono-infection par les germes les plus résistants.
Une sélection de microorganismes s’opère en fonction de leur résistance aux agents et matériaux utilisés au cours du traitement et de leur capacité à survivre dans un environnement pauvre en nutriments. Les bactéries qui ont subsisté dans les vides entre l’obturation et les parois du canal, et dans les zones non obturées (tiers apical, canaux latéraux), dérivent les fluides d’origine péri-apicale et coronaire pour leur nutrition. Selon l’augmentation et la diminution des conditions écologiques du milieu canalaire, l’inoculation septique peut changer d’intensité et faire évoluer la réaction (du chronique à l’aigu et vice-versa).
Classifications des Infections Endodontiques
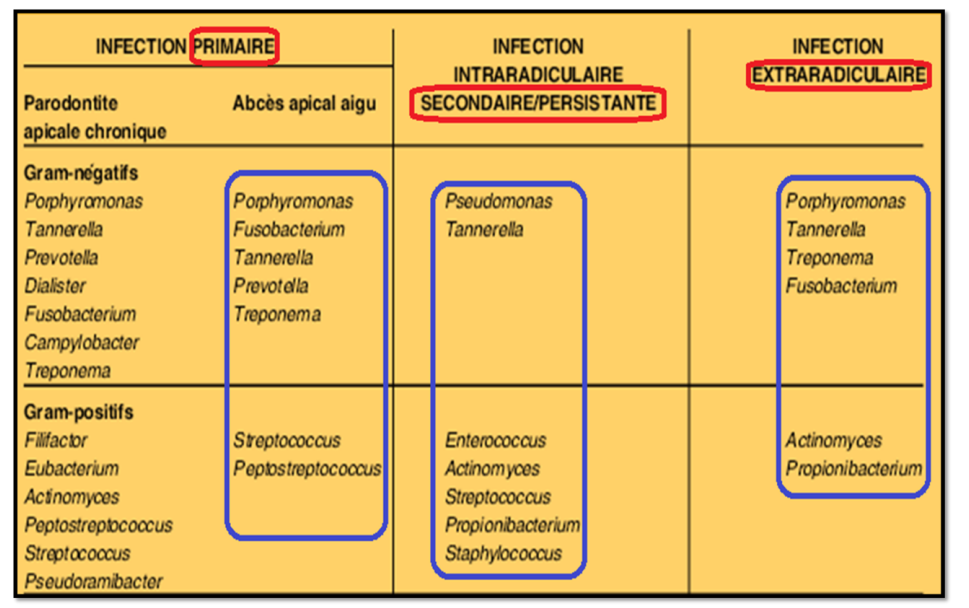
Les infections endodontiques peuvent être classées en :
- Selon le site anatomique :
- Infection extra-radiculaire
- Infection intra-radiculaire
- Selon la séquence temporelle de colonisation par les microorganismes :
- Infection intra-radiculaire primaire
- Infection intra-radiculaire secondaire
- Infection intra-radiculaire persistante
Infection Intra-Radiculaire
Subdivisée en trois catégories selon le moment où les microorganismes ont pénétré l’endodonte :
- Infection intra-radiculaire primaire : provoquée par les microorganismes qui envahissent et colonisent initialement le tissu pulpaire nécrotique, désignée sous le nom d’infection initiale. Flore microbienne dominée par les bactéries anaérobies Gram- mais aussi des Gram+.
- Infection intra-radiculaire secondaire : provoquée par des microorganismes qui n’étaient pas présents au moment de l’infection primaire, mais qui ont été introduits à l’occasion d’une intervention professionnelle (pendant le traitement, entre deux rendez-vous ou après traitement). Principales causes de pénétration en cours de traitement :
- Présence de plaque, tartre ou tissu carié sur la couronne.
- Digue non étanche.
- Contamination des instruments endodontiques et solutions d’irrigation.
- Entre les séances de soin : percolation à travers le matériau de restauration temporaire, fracture ou perte de restauration provisoire, dent laissée ouverte pour assurer le drainage.
- Après la fin du traitement canalaire : infiltration par le matériau de restauration provisoire/permanent, fracture/perte de la restauration temporaire ou permanente, fracture des tissus dentaires, récidive carieuse exposant l’obturation canalaire, retard dans la pose d’une restauration permanente.
- Infection intra-radiculaire persistante ou récurrente : provoquée par des microorganismes qui ont résisté aux procédures antimicrobiennes intra-canalaires et capables de supporter des périodes de privation nutritionnelle dans le/les canaux traités. La flore microbienne se compose d’un nombre inférieur à des infections primaires où prédominent les bactéries facultatives Gram+ : Enterococcus faecalis avec une fréquence des champignons supérieure à celle de l’infection primaire. Les infections secondaires et persistantes sont responsables de :
- L’exsudation persistante.
- La persistance de symptomatologie.
- L’exacerbation entre les séances de soins.
- L’échec de traitement endodontique avec persistance de LIPOE.
Localisation
Les bactéries de la flore endodontique colonisent la totalité du réseau canalaire radiculaire. On les retrouve :
- Sur les restes de tissu pulpaire nécrotique, éléments nutritifs nécessaires à leur croissance.
- Le long des parois canalaires, par adhésion les unes aux autres formant un biofilm.
- Dans les canaux accessoires et les deltas apicaux.
- À l’intérieur des tubuli dentinaires sur une profondeur de plusieurs centaines de microns à partir de la lumière canalaire. Les bactéries se logent préférentiellement dans le premier tiers de la dentine péricanalaire si le cément est intact. Dans le cas contraire, une deuxième source nutritionnelle provenant de l’extérieur permet une fixation bactérienne sur le collagène des tubulis.
Infection Extra-Radiculaire
Caractérisée par l’invasion microbienne des tissus périradiculaires enflammés :
- Peut être primaire, secondaire ou persistante.
- C’est une séquelle de l’infection intra-radiculaire.
- Elle est la cause de nombreux échecs de traitement.
- Les bactéries, insensibles aux manœuvres d’antisepsie intra-canalaire, se trouvent dans les cryptes cimentaires apicales, hors d’atteinte d’un traitement. On identifie surtout des Actinomyces.
Pathogénèse et Structure de la Lésion
Explications des symboles :
Comme toujours au niveau d’un tissu conjonctif, tous les facteurs étiologiques cités précédemment sont susceptibles d’engendrer une inflammation péri-apicale. S’il y a possibilité de mémorisation du facteur étiologique, la colonisation de la pulpe par les bactéries induit une réaction immunitaire innée/acquise décrite, puis dans le parodonte périradiculaire en regard des foramina apicaux et latéraux. Cela aboutira à la formation d’une LIPOE. Dans l’espace périapical, les bactéries issues du canal radiculaire sont directement confrontées au système général de défense de l’hôte. Un équilibre précaire s’installe, dont l’issue est une réaction périapicale sous plusieurs formes. Cette réaction, à savoir la formation d’une LIPOE, nécessite des conditions locales particulières, à savoir :
- Une quantité suffisante de microorganismes pathogènes pour initier et maintenir l’infection périradiculaire.
- Un environnement canalaire permettant la survie et la croissance des microorganismes.
- Une réponse de défense au niveau péri-radiculaire.
Dynamique Inflammatoire et Immunopathologie
La réaction inflammatoire est un ensemble de mécanismes physiologiques de défense visant à circonscrire et à réparer les lésions tissulaires. Sur le plan clinique, la réaction inflammatoire entraîne : œdème, douleur, rougeur, chaleur. Les LIPOE sont le résultat direct d’une infection bactérienne d’origine endodontique au niveau péri-apical. Ce processus met en opposition des facteurs bactériens et des facteurs de défense de l’hôte qui tentent de faire éloigner l’os alvéolaire du site infecté par résorption, le résultat sera donc l’image radio-claire périapicale caractéristique des LIPOE.
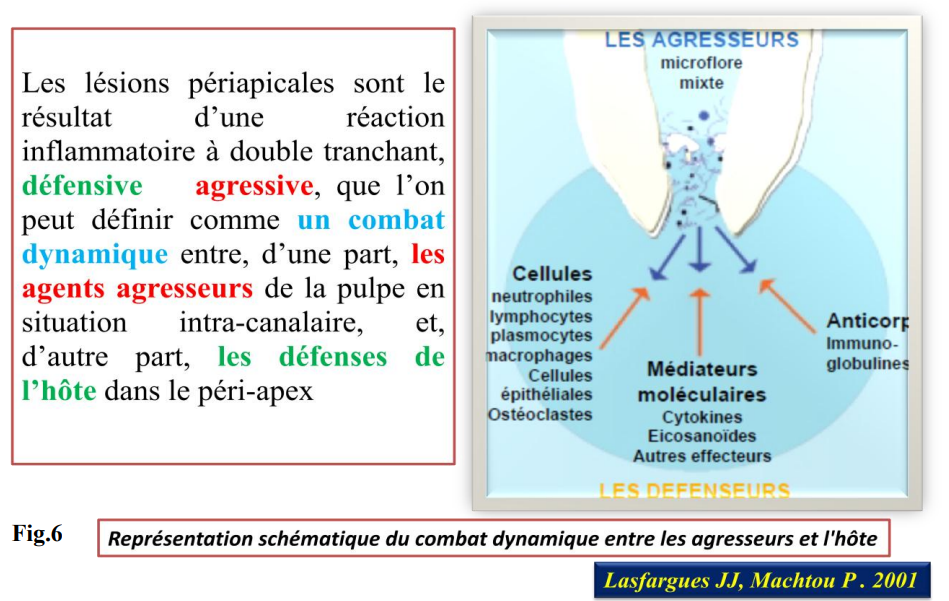
Les lésions péri-apicales sont le résultat d’une réaction inflammatoire à double tranchant, défensive et agressive, qui traduit l’antagonisme entre les agents agresseurs, les facteurs de défense de l’hôte et les médiateurs de l’inflammation.
Les Agents Agresseurs
- Bactéries dont la virulence et la pathogénicité sont variables.
- Sous-produits bactériens qui ont des effets divers :
- Les enzymes protéolytiques détruisent des complexes immuns et altèrent l’action des anticorps. Ils facilitent la pénétration des bactéries dans le périapex.
- Les exotoxines antigéniques sollicitent les médiateurs de l’inflammation tels que les cytokines.
Les Facteurs de Défense de l’Hôte
Les premières cellules impliquées au cours de l’évolution des LIPOE sont :
- Dans les phases aiguës : les polymorphonucléaires neutrophiles et les macrophages.
- Dans les phases chroniques : les lymphocytes B et T ainsi que les plasmocytes.
Les Médiateurs de l’Inflammation
Produits par les différentes cellules pour détruire les microorganismes pathogènes :
- Prostaglandines : favorisent vasodilatation et activation des ostéoclastes.
- Amines vasoactives (kinines et neuropeptides) : interviennent dans vasodilatation, chimiotactisme et activité phagocytaire des PMNs.
- Cytokines : participent de façon active à la destruction des tissus périapicaux (résorption osseuse).
- Anticorps produits par les plasmocytes : IgG, IgA, IgE et IgM.
La réaction inflammatoire produit deux effets :
- Limite la prolifération bactérienne.
- Destruction tissulaire localisée.
Les lésions péri-apicales sont le résultat d’une réaction inflammatoire à double tranchant, défensive et agressive, que l’on peut définir comme un combat dynamique entre, d’une part, les agents agresseurs de la pulpe en situation intra-canalaire, et, d’autre part, les défenses de l’hôte dans le péri-apex.
Évolution des Réactions Périapicales
Les LIPOE sont la traduction de l’inflammation au sein du tissu conjonctif, à la suite d’une infection endodontique. Selon l’intensité du facteur étiologique, les réactions péri-apicales peuvent être aiguës ou chroniques :
- Symptomatiques (aiguës) : réponse initiale aiguë et exacerbation primaire, avec la clinique correspondante. Il s’agit d’une réponse de l’hôte, intense et de courte durée, initiée par les bactéries du canal infecté, un traumatisme ou une agression iatrogénique. Elle est caractérisée par une hyperémie, une congestion vasculaire, un œdème du desmodonte, une extravasation des neutrophiles et des monocytes et une résorption osseuse limitée. Histologiquement :
- Les modifications tissulaires sont limitées à l’espace desmodontal péri-apical.
- La réaction ostéoclastique est très rapidement déclenchée par l’accumulation des médiateurs qui intervient avant la nécrose totale de la pulpe.
- Ceci explique la présence possible d’images apicales radio-claires alors qu’il subsiste un tronçon apical pulpaire vital.
- Au stade aigu initial, plusieurs voies sont possibles : l’amplification de l’inflammation et la formation d’un abcès primaire ; l’abcédation et la fistulisation, ou l’évolution vers la chronicité (granulomes et kystes).
- Asymptomatiques (chroniques) : si la cause a une faible puissance, la réponse devient secondaire (chronique) et persiste, l’inflammation devient une réaction immunologique, peut passer inaperçue ou presque. Dans cette dernière éventualité, si la cause persiste, l’inflammation devient asymptomatique (chronique). La parodontite apicale en est la première étape, dont le granulome est la forme la plus fréquente d’une lésion passée à la chronicité et pouvant évoluer vers le kyste. La chronicité de la lésion témoigne de l’équilibre entre les bactéries et les défenses de l’hôte. S’il y a une atténuation des phénomènes aigus, cela passe à la chronicité.
- Évolution aiguë sur chronique : en présence d’espèces plus virulentes ou de déficience des défenses, les germes peuvent franchir l’apex et provoquer un accident infectieux extra-radiculaire. La réaction péri-apicale chronique devient aiguë, l’évolution aiguë est le signe que cet équilibre est rompu et que les défenses sont débordées. Cela peut conduire à la cellulite, une réaction inflammatoire diffuse, dans laquelle les défenses sont incapables de contenir l’infection localement. L’apparition de facteurs étiologiques supplémentaires (intenses/légers et continus) peut entraîner le réchauffement d’une réaction chronique (asymptomatique).
- Ces évolutions ne sont pas seulement en rapport avec des variations de la valeur du facteur étiologique, mais aussi avec celles de la réponse de l’organisme à ce facteur.
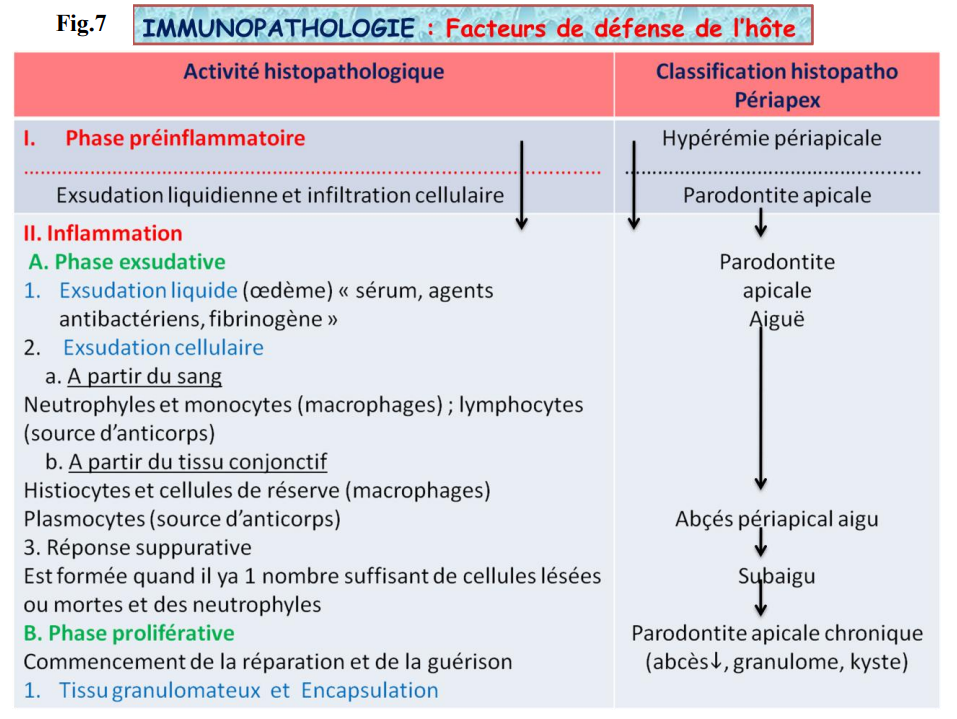
Activité Histopathologique
Phase Préinflammatoire
- Exsudation liquidienne et infiltration cellulaire.
Inflammation
Phase Exsudative
- Exsudation liquide (œdème) : sérum, agents antibactériens, fibrinogène.
- Exsudation cellulaire :
- À partir du sang : neutrophiles et monocytes (macrophages) ; lymphocytes (source d’anticorps).
- À partir du tissu conjonctif : histiocytes et cellules de réserve (macrophages), plasmocytes (source d’anticorps).
- Réponse suppurative : formée quand il y a un nombre suffisant de cellules lésées ou mortes et de neutrophiles.
Phase Proliférative
Commencement de la réparation et de la guérison :
- Tissu granulomateux et encapsulation.
- Hyperémie périapicale.
- Parodontite apicale.
- Abcès périapical aigu.
- Parodontite apicale chronique (abcès, granulome, kyste).
Classification des LIPOE
Classification selon F.S. Weine
Pathologie Pulpo-Périapicale Symptomatique
- Parodontite apicale aiguë – forme commençante ou exsudative.
- Parodontite apicale aiguë – forme avancée ou suppurative :
- Abcès péri-apical aigu.
- Abcès recrudescent (phénix).
- Abcès péri-apical subaigu.
Pathologie Pulpo-Périapicale Asymptomatique
- Pulpo-ostéosclérose périapicale (ostéite condensante, ostéite sclérosante).
- Parodontite apicale chronique – forme commençante.
- Parodontite apicale chronique – formes avancées :
- Granulome périapical (parodontite apicale proliférative).
- Kyste périapical (parodontite apicale proliférative).
- Abcès péri-apical chronique (parodontite apicale suppurative).
Classification selon Hess
Desmodontite Aiguë
- Primaire : séreuse ou congestive.
- Secondaire : desmodontite suppurée.
Desmodontite Chronique
Classification selon l’OMS
Périodontite Apicale Aiguë
- Périodontite apicale aiguë d’origine pulpaire.
- Abcès périapical sans fistule.
- Abcès périapical.
Périodontite Apicale Chronique
- Granulome apical.
- Kyste radiculaire, comprend :
- Kyste radiculaire apical et latéral, résiduel, parodontal, inflammatoire (à l’exclusion des kystes latéraux liés au développement).
- Abcès périapical avec fistule s’ouvrant dans le sinus maxillaire, dans la fosse nasale, dans la cavité buccale, fistule dermique.
- Maladies de la pulpe et des tissus périapicaux, autres et sans précision.
Classification selon Nair (1997)
Basée sur :
- La distribution des cellules inflammatoires dans la lésion.
- La présence ou l’absence de cellules épithéliales.
- L’évolution kystique ou non.
- Le rapport entre la cavité kystique et le canal radiculaire.
- Parodontite apicale aiguë : inflammation aiguë du périapex.
- Primaire : inflammation de courte durée initiée sur un apex sain.
- Secondaire ou d’exacerbation aiguë : réponse aiguë sur une parodontite chronique déjà existante.
- Parodontite apicale chronique ou granulome apical : inflammation évoluant sur une longue durée, caractérisée par la présence d’un tissu de granulation, infiltration de lymphocytes, plasmocytes et macrophages.
- Kyste périapical : kyste inflammatoire avec un épithélium distinct délimitant une cavité, kyste vrai et kyste en poche ou en baie.
Classification Symptomatologique à but Thérapeutique des Pulpopathies (Modifiée d’après L.J. Baume et G. Fiore Domo, 1962)
| Catégorie | Description |
|---|---|
| Catégorie 1 | Pulpe vivante sans symptomatologie, lésée accidentellement ou proche d’une carie ou cavité profonde, susceptible d’être protégée par coiffages. |
| Catégorie 2 | Pulpe vivante avec symptomatologie dont on tentera, surtout chez les jeunes, de conserver la vitalité par coiffage ou biopulpotomie. |
| Catégorie 3 | Pulpe vivante dont la biopulpectomie suivie d’une obturation radiculaire immédiate est indiquée pour des raisons symptomatologiques, prothétiques, iatrogènes ou de pronostic. |
| Catégorie 4 | Pulpe nécrosée avec, en principe, infection de la dentine radiculaire accompagnée ou non de complications périapicales, exigeant un traitement canalaire antiseptique et une obturation canalaire hermétique. |
Sémiologie et Diagnostic
La démarche diagnostique repose sur l’anamnèse médicale et dentaire, complétée par l’analyse des symptômes puis des signes cliniques par différents moyens : l’examen visuel des surfaces dentaires, gingivales et muqueuses, palpation, tests de sensibilité pulpaire, sondage parodontal, tests de percussion, évaluation de la mobilité dentaire, et l’examen radiologique. De nouveaux outils de diagnostic sont développés, comme des tests de la vitalité pulpaire reposant sur l’échographie Doppler.
Interrogatoire
Il faut déterminer le caractère de la douleur pour différencier entre les algies d’origine pulpaire et d’autres algies orofaciales.
Examen Exobuccal
Inspection et palpation.
Examen Endobuccal
Permettra de reconnaître les signes objectifs de la pathologie :
- Signes dentaires : caries profondes, restaurations étendues, défectueuses/nocives, dyschromies dentaires, fêlures et fractures.
- Signes parodontaux : inflammation parodontale marginale, abcès, cellulite, fistules.
- Signes fonctionnels.
Tests Complémentaires de Diagnostic
Tests de Sensibilité Pulpaire
Ils comprennent les tests thermiques (froid et chaud) et électrique : une réponse négative indique que la pulpe est nécrosée et constitue un des signes cardinaux indispensable au diagnostic des LIPOE.
Tests d’Identification
- Test de percussion : permet de détecter une inflammation desmodontale, en stimulant les terminaisons proprioceptives et nociceptives péridentaires.
- Test de palpation intra-orale : mené dans le vestibule, à la recherche d’un point douloureux ou d’une zone inflammatoire sensible. Il permet également de diagnostiquer la disparition de la corticale osseuse vestibulaire : si l’os péri-apical a disparu, on constate le signe du godet (signe de Crâne).
- Test du cône de gutta-percha : l’introduction d’un cône de gutta-percha dans l’ostium permet de suivre le trajet fistuleux jusqu’à sa source.
- Autres tests pouvant être utiles : le sondage parodontal.
Examen Radiographique
- La radiographie rétro-alvéolaire est un élément décisif et suffisant pour établir le diagnostic des parodontites apicales.
- En l’absence de symptômes et signes cliniques, la radiographie est le moyen exclusif de diagnostic des parodontites apicales chroniques.
- Pour la prise des clichés rétro-alvéolaires, la technique des rayons parallèles en incidence orthogonale doit être privilégiée.
Points clés du diagnostic radiographique :
- Les signes radiographiques doivent toujours être corrélés aux signes cliniques et aux autres tests diagnostiques pour établir un diagnostic positif étiologique et différentiel.
- L’apparence radiographique d’une lésion péri-apicale est toujours sous-dimensionnée par rapport à son extension histologique réelle.
- La présence de signes radiographiques nets (disparition de la lamina dura et radio-clarté apicale) est quasi pathognomonique des LIPOE chroniques. L’absence de signes radiographiques n’indique pas obligatoirement l’absence de pathologie : généralement, des lésions débutantes, aiguës voire chroniques, localisées à l’os médullaire en présence de corticales épaisses, sont radiologiquement invisibles.
- La radiographie ne permet pas de distinguer entre un granulome et un kyste.
- Des images radioclaires transitoires peuvent apparaître après un traumatisme ou un traitement endodontique.
- Des images radioclaires de cicatrisation imparfaite peuvent persister après traitement endocanalaire ou chirurgical.

Éléments Radiologiques de Diagnostic des Parodontites Apicales
| Périapex Sain | Parodontites Apicales | Structures Anatomiques | Autres Pathologies |
|---|---|---|---|
| Normalité : – du dôme apical – du canal radiculaire – du foramen apical – du cément – de l’espace desmodontal – de la lamina dura – de l’os cortical – de l’os médullaire | – Modifications structures osseuses – Élargissement desmodontal – Disparition de la lamina dura – Radio-clarté diffuse – Radio-clarté circonscrite – Densification osseuse | – Canal incisif maxillaire – Cavités nasales – Fosses canines – Sinus maxillaire – Arc zygomatique – Canaux nourriciers – Trou mentonnier – Canal alvéolaire inférieur – Tori palatin et mandibulaire | – Parodontites marginales – Fêlures et fractures radiculaires – Tumeurs et kystes des maxillaires : kystes parodontaux, dentigère, embryologique, résiduels, traumatique, améloblastome, dysplasie cémentaire, granulome à cellules géantes, hémangiome – Maladies systémiques |

Démarche Diagnostique Systématisée
- Motif de la consultation : enregistrer les symptômes et problèmes du patient (parodontite apicale aiguë = urgence).
- Anamnèse médicale et dentaire : enregistrer les données utiles passées et présentes.
- Entretien avec le patient : caractériser la douleur.
- Hypothèse diagnostique : probabilité d’une maladie pulpo-parodontale.
- Observation clinique : examen extra et intra-oral, tests cliniques, examen radiographique. Rechercher les signes et symptômes correspondant aux critères de diagnostic spécifiques à la maladie.
- Formulation du diagnostic :
- Étiologique : indiquer la cause de l’infection endocanalaire.
- Positif : identifier les trois critères clés caractérisant la parodontite apicale.
- Différentiel : identifier les signes et symptômes caractérisant la forme clinique de la parodontite apicale.
Les trois critères clés permettant de poser un diagnostic de LIPOE :
- L’existence d’une voie de contamination bactérienne endo-parodontale.
- Une réponse négative aux tests de sensibilité pulpaire.
- Une image osseuse radio-claire d’origine endodontique.
Autres signes et symptômes :
- Douleur, réponses positives aux tests de percussion et palpation, fistule et tuméfaction sont inconstants et dépendent du statut des différentes formes de lésions péri-apicales.
- Le critère diagnostique qui permet de différencier les maladies de la pulpe des maladies pulpo-parodontales est l’absence de réponse aux tests de sensibilité pulpaire.
- Une palpation apicale très douloureuse signe la présence d’une collection suppurée, alors qu’une palpation sensible renseigne plus sur un état inflammatoire.
Tests Diagnostiques et Hypothèses de Corrélations Pathologiques
| Pathologie | Anamnèse | Palpation | Percussion | Morsure | Froid | Chaud | Électrique | Cavité |
|---|---|---|---|---|---|---|---|---|
| Nécrose pulpaire | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| LIPOE aiguë | ++ | + | ++ | ++ | 0 | 0 | 0 | ++ |
| LIPOE chronique | + | + | + | + | 0 | 0 | 0 | 0 |
| Abcès apical aigu | ++ | ++ | ++ | ++ | 0 | 0 | 0 | ++ |
Formes Cliniques
Pathologies Péri-Apicales Symptomatiques ou Aiguës
Les parodontites apicales symptomatiques sont des réponses inflammatoires du tissu conjonctif au cours desquelles les forces exsudatives prédominent. Les symptômes douloureux sont provoqués par une augmentation de la pression intra-péri-apicale.
- Primaire : l’inflammation du péri-apex commence par une phase aiguë.
- Secondaire : accident aigu survient sur une parodontite chronique préexistante.
Parodontite Apicale Aiguë Primaire – Forme Commençante ou Exsudative
À un stade débutant, encore appelée pulpo-desmodontite, elle correspond au passage de l’inflammation pulpaire dans le périapex. À un stade avancé, l’inflammation s’installe dans le péri-apex et correspond à une inflammation exsudative sévère.
Histopathologie :
- Les modifications sont limitées : congestion vasculaire, œdème du desmodonte, faible résorption osseuse.
Symptomatologie :
- Symptomatologie subjective :
- Douleur vive, spontanée, continue et accentuée par le contact de la dent et la pression, rebelle aux antalgiques, peut diminuer sans pour autant céder, sensation d’extrusion dentaire.
- Symptomatologie objective :
- La muqueuse en regard de la dent est hyperémiée et œdématiée.
- Tests de sensibilité pulpaire généralement négatifs sauf si certaines fibres nerveuses subsistent (+/-).
- Réponses positives à la parodontite apicale aiguë débutante, négatives à la parodontite apicale aiguë installée.
- Percussion de plus en plus douloureuse : évolution (débutante/installée) (++ signe pathognomonique de l’atteinte ligamentaire).
- La dent est légèrement mobile.
- La chaleur augmente les phénomènes douloureux.
Radiologie :
- Phase débutante : lésion non visible, quelques jours après, elle sera plus clairement visible à la radiographie par propagation de l’infection.
- Espèces plus virulentes ou déficit des mécanismes de défense de l’hôte : l’infection peut se propager dans la région périradiculaire où elle sera plus clairement visible à la radiographie rétro-alvéolaire après quelques jours seulement.
Diagnostic :
- Diagnostic différentiel : pulpite symptomatique, atteinte septale, pulpo-desmodontite, trauma occlusal, abcès péri-apical aigu, maladies extradentaires (ex. : sinusites).
- Évolution : vers l’abcès primaire si aucun traitement n’est entrepris. Une fistulisation secondaire peut parfois s’installer. La chronicité est le dernier stade évolutif avec l’apparition de lésions granulomateuses ou kystiques.
Parodontite Apicale Aiguë – Forme Avancée ou Suppurative
Abcès Périapical Aigu
C’est une réponse inflammatoire suppurative avancée et sévèrement symptomatique des tissus conjonctifs péri-apicaux. En plus des causes déjà citées, l’abcès péri-apical aigu peut faire suite à une parodontite apicale aiguë non traitée. La présence d’espèces bactériennes plus virulentes (Bacteroides associés à des Peptostreptococcus et autres bactéries) peut entraîner le débordement des défenses immunitaires et provoquer l’infection purulente. Cette lésion est caractérisée par l’accumulation de pus au niveau péri-apical.
Histopathologie :
- Les mouvements cellulaires s’intensifient, les neutrophiles et monocytes prolifèrent.
- Exsudat massif apparaît et la résorption osseuse s’installe.
- Des foyers de nécrose apparaissent au centre de l’abcès.
Symptomatologie :
- Symptomatologie subjective :
- D’ordre local : douleurs spontanées continues, résistent aux antalgiques et peuvent diminuer sans pour autant céder complètement, d’intensité variable et localisée à tous les stades. Douleurs provoquées par tout élément susceptible d’augmenter la congestion de l’espace péri-apical et la mobilité de la dent (chaleur, percussion et pression). Sensation d’une dent longue.
- D’ordre général : le malade est épuisé, fatigué, fièvre et adénopathies dans le territoire ganglionnaire correspondant à la dent.
- Symptomatologie objective :
- Les tests de sensibilité pulpaire sont négatifs.
- Le contact de la dent est intolérable et la percussion (+++) doit être évitée.
- La palpation en regard de l’apex est douloureuse, faisant suspecter la présence de pus.
- Les signes parodontaux sont associés avec parfois une tuméfaction sous-périostée étendue et diffuse.
- La présence de tartre est +/- importante.
- Mobilité (++).
Radiographie :
- Un léger élargissement ligamentaire.
- La lésion devient radio-visible au bout de 3 à 4 semaines.
- L’abcès péri-apical aigu n’est pas nécessairement visible radiographiquement. Il peut être un abcès entièrement interosseux, sans atteinte des corticales.
Diagnostic :
- Diagnostic différentiel :
- Maladies dentaires : pulpites symptomatiques, syndrome du septum, parodontite apicale primaire, abcès parodontal, évolution des dents de sagesse.
- Maladies extradentaires : sinusite maxillaire aiguë, les dents antrales douloureuses à la pression et à la percussion, algies de la face.
- Évolution : se fait vers l’extériorisation du pus péri-apical soit :
- Vers la cavité buccale : donne naissance à une fistule, par deux voies possibles : à travers la table alvéolaire la plus mince, puis la gencive ou le long de l’espace desmodontal, jusqu’au collet.
- Vers les tissus péribuccaux : donne des cellulites ou bien des ostéites selon que la diffusion se fait vers les espaces cellulaires maxillo-faciaux ou vers le tissu osseux.
- Vers le sinus maxillaire : pour les prémolaires et molaires supérieures, dites dents antrales, la diffusion du pus vers le sinus maxillaire est d’autant plus aisée que l’espace osseux qui sépare les apex du sinus est plus mince.
Abcès Recrudescent (Abcès Phénix)
C’est une affection apicale qui se développe comme une exacerbation aiguë d’un abcès chronique ou d’un granulome. Il apparaît lorsque des éléments émanant du canal radiculaire viennent infecter ou contaminer une zone granulomateuse.
Symptomatologie :
- Les symptômes sont identiques à ceux d’un abcès péri-apical aigu, la différence principale étant que l’abcès recrudescent est précédé par un état inflammatoire chronique avec une caractéristique : une image radio-claire étendue au niveau de la région péri-apicale toujours décelable du fait de la destruction osseuse préexistante.
Diagnostic :
- Diagnostic différentiel : abcès apical aigu, abcès parodontal.
- Diagnostic positif : basé sur la symptomatologie aiguë et l’examen radiographique qui révèle une zone de raréfaction osseuse péri-apicale importante ainsi que l’histoire de la maladie.
Évolution :
- Cette première réponse chronique est faible et augmente d’autant plus que les produits de nécrose et les microorganismes diffusent du canal pulpaire dans l’apex aboutissant à la formation :
- D’un granulome ou d’un kyste péri-apical.
- D’une parodontite apicale aiguë secondaire.
Abcès Péri-Apical Subaigu
C’est une phase de transition entre les étapes symptomatiques (aiguës) et asymptomatiques (chroniques). Il existe les aspects exsudatifs de l’inflammation aiguë en même temps que les aspects prolifératifs caractéristiques de l’inflammation chronique dans un équilibre délicat et une réciprocité pour la prédominance d’une phase sur l’autre.
Symptomatologie :
- Lorsqu’elle existe, généralement légère et de faible intensité.
Pathologies Péri-Apicales Asymptomatiques
Les maladies pulpo-péri-apicales asymptomatiques sont des réponses inflammatoires de défense du tissu conjonctif péri-apical en face d’une irritation pulpaire ; la composante proliférative (chronique ou granulomateuse) y joue un rôle prédominant. La douleur est absente car la pression intra-péri-apicale est diminuée et équilibrée.
Pulpo-Ostéosclérose (Ostéite Condensante ou Ostéite Sclérosante)
Définition :
- C’est une réponse proliférative de l’os péri-apical (densification) à une irritation pulpaire de faible intensité et de longue durée. C’est une inflammation chronique du péri-apex avec une image caractéristique de radio-densité apicale résultant de l’activité ostéoblastique au lieu de la résorption associée à l’inflammation péri-apicale (activité ostéoclastique). On rencontre typiquement cette réaction chez les personnes jeunes, autour des apex des dents inférieures portant de grandes lésions carieuses et une pulpe en état d’inflammation chronique.
Histopathologie :
- Le tissu osseux résiste à l’infection et ne se dégrade pas mais prolifère en formant de l’os plus dense, cette densification de l’os trabéculaire avec raréfaction des espaces médullaires qui sont infiltrés par les lymphocytes.
Symptomatologie :
- Nulle.
Image radiologique :
- Montre une augmentation de la densité de l’os péri-apical, trabécules osseuses épaisses, espaces médullaires disparaissent ou se réduisent à petits points de tissus fibreux.
Diagnostic différentiel :
- Tumeurs bénignes et dysplasies cémentaires ou cémentomes.
Pronostic :
- Les auteurs estiment un retour à la trabéculation normale après un traitement endodontique.
Parodontite Apicale Chronique – Forme Commençante
Définition :
- C’est une réponse chronique du tissu conjonctif péri-apical en face d’une irritation pulpaire faible. L’inflammation est partielle.
Histologie :
- À cause de l’inflammation, la cémentogenèse et l’ostéogenèse sont interrompues, il se produit des phénomènes de lyse osseuse. L’épaississement œdémateux du tissu enflammé entraîne une augmentation radio-visible de l’espace desmodontal. Le desmodonte subit des modifications pour se transformer en tissu de granulation.
Symptomatologie :
- Quasi inexistante. L’épaississement du desmodonte a pour effet d’engendrer un certain nombre de signes cliniques très modérés et inconstants, seulement objectifs :
- Matité à la percussion de la dent.
- Sensation de « dent montée sur caoutchouc », ou « plus longue ».
Radiographie :
- Épaississement de l’espace desmodontal.
- Disparition de l’image de la lamina dura.
- Image péri-apicale diffuse sans contours ni limites.
Évolution :
- Se fait vers la formation d’un granulome, d’un kyste péri-apical ou d’une LIPOE aiguë secondaire.
Parodontite Apicale Chronique – Forme Avancée
Granulome Périapical ou Parodontite Périapicale Proliférative
Définition :
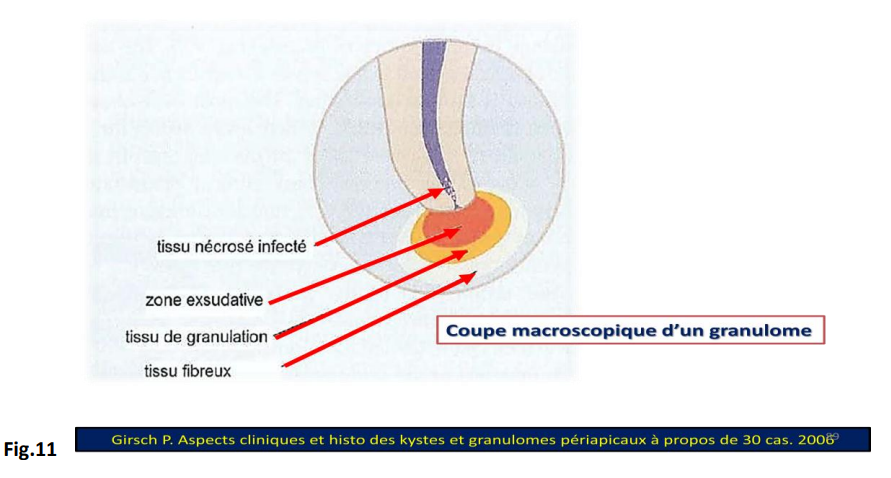
- C’est une forme avancée de la LIPOE chronique, elle est proliférative. Il s’agit d’une réaction inflammatoire du conjonctif péri-apical de type particulier qui aboutit à la formation d’un tissu granulomateux péri-apical en réponse à une irritation pulpaire continue et entouré par une capsule périphérique de fibres de collagène : c’est une pseudo-tumeur bénigne inflammatoire. Elle est associée à une réaction immunitaire médiate et cellulaire spécifique du desmodonte au contenu canalaire qui siège souvent à l’apex d’une dent.
Pathogénèse :
- La formation du granulome se fait à partir des constituants de la gangrène pulpaire.
- On assiste à une réponse immunitaire spécifique par différenciation des lymphocytes T et B.
- Constituée de 4 zones de Fish :
- Zone I : zone de nécrose, zone d’infection : noyau de pus contenant des cellules mortes, les toxines provenant du canal radiculaire infecté ou nécrotique. Les bactéries peuvent être présentes ou non.
- Zone II : zone de contamination, zone exsudative primaire : caractérisée par la présence de cellules blanches polynucléaires entourées de lymphocytes. Les bactéries sont absentes mais agissent par le biais de leurs toxines. Elle est caractérisée par une activation des ostéoclastes qui entraînent une résorption de l’os péri-apical contaminé.
- Zone III : zone d’irritation, zone granulomateuse, zone proliférative primaire : c’est un tissu de réparation et de guérison formé de néo-capillaires et de néo-fibroblastes. C’est également un tissu de défense (lymphocytes, plasmocytes, macrophages). On note la présence de débris épithéliaux en grand nombre, mais pas de microorganismes.
- Zone IV : zone de stimulation, zone d’encapsulation, zone de production fibreuse : à la périphérie de la zone d’irritation, les éléments irritatifs canalaires sont si dilués qu’ils deviennent des stimulants pour les fibroblastes et les ostéoblastes. Le granulome est un environnement défavorable pour les bactéries, il est propice à la destruction qu’à la prolifération bactérienne. Il reflète un stade d’équilibre entre l’agent pathogène et la défense autocontrôlée ce qui peut rester plusieurs années asymptomatiques et sans modifications radiologiques.
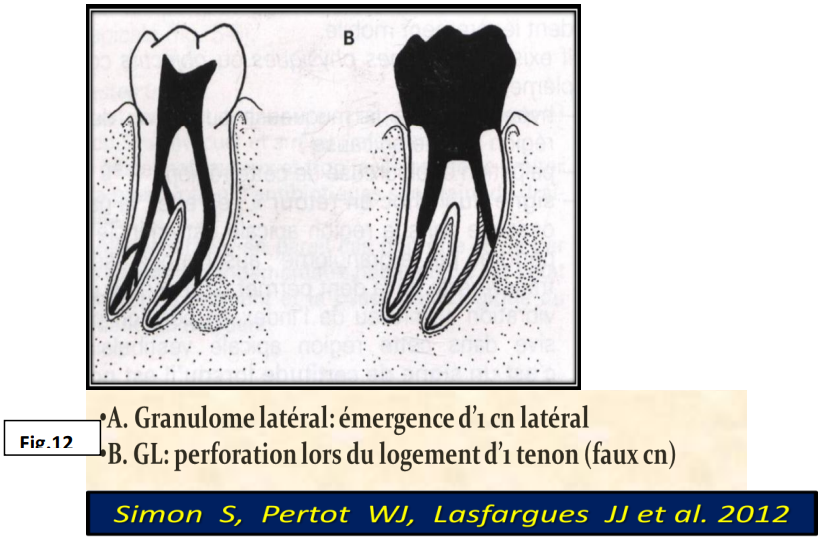
Différents sièges des granulomes :
- Granulome apical : se situe à l’apex d’une dent au niveau du foramen apical.
- Granulome latéro-radiculaire : se situe au niveau d’un canal latéral ou d’un faux canal.
- Granulome inter-radiculaire : se développe au niveau des canaux accessoires de la bifurcation ou au niveau des perforations du plancher pulpaire.
Symptomatologie :
- Signes subjectifs :
- Sensation de dent « montée sur caoutchouc », « plus longue », ressentie par le malade quand il serre les dents.
- Gêne, plutôt que douleur, mal localisée.
- Rougeur dans le vestibule en regard de l’apex de la dent.
- Signes objectifs :
- Aucune réaction aux tests de sensibilité.
- La percussion axiale de la dent rend un son plus mat que celle des dents saines, voisines ou homologues, elle engendre rarement une sensibilité.
- On peut mettre en évidence une très légère mobilité.
- La percussion transversale : choc en retour (si le granulome est sous-muqueux).
- La palpation du vestibule ne réveille aucune douleur, si l’os péri-apical a disparu, la pression exercée par la pulpe de l’index, ou mieux par une boulette de coton, dans la région apicale peut faire apparaître un « signe du godet ou signe de crâne », témoin d’un œdème, si on appuie avec le manche d’un miroir, on laisse son empreinte dans la muqueuse. Ce signe n’est possible que si le granulome est sous-muqueux, après qu’il ait trépané la table externe de l’os alvéolaire, nécessairement mince.
- Le passage répété du doigt au niveau de la zone suspectée peut engendrer un frémissement ressenti à la fois par le praticien et par le malade.
- Ces signes objectifs sont possibles mais souvent inexistants, c’est pourquoi l’examen clinique doit toujours être complété par une investigation radiographique.
Examen radiographique :
- Au stade de début, une image de radio-densité très faible en croissant de lune épousant la portion terminale du tiers apical de la racine.
- L’image radiographique du granulome montre une zone radio-claire, le plus souvent péri-apicale, développée aux dépens de l’os alvéolaire, avec disparition de la lamina dura. Son diamètre ne dépasse pas 5 millimètres.
- Le contour est relativement net, un contour plus flou est le résultat d’une légère décalcification osseuse consécutive à une poussée inflammatoire aiguë du granulome, voire suppurée.
- Quand le granulome est ancien, il est entouré d’une zone radio-opaque de sclérose osseuse et la résorption de l’apex donne un aspect « sucé » à celui-ci.
- Il faut éviter de confondre une image anatomique (trou mentonnier, fossette) avec l’image du granulome.
Diagnostic différentiel :
- Se fait avec toutes les images radio-claires péri-apicales pathologiques.
Évolution :
- Si on supprime l’infection et tous les sous-produits microbiens antigéniques, le granulome disparaît et le desmodonte guérit.
- Seulement dans le cas d’épithélio-granulome, on peut assister à une évolution kystique.
- Par contre, dans tous les cas, il est possible qu’à la suite d’une réactivation de l’antigène, une évolution aiguë apparaisse.
- La réactivation inflammatoire provient probablement d’une invasion bactérienne plus massive ou d’un phénomène de surinfection.
Kyste Radiculo-Dentaire
Définition :
- C’est une réponse inflammatoire du péri-apex, qui se développe à partir de lésions chroniques avec préexistence de tissu granulomateux. Il est caractérisé par une cavité centrale délimitée par un épithélium et remplie de liquide ; il est entouré par un tissu granulomateux et une capsule fibreuse périphérique. Le kyste radiculo-dentaire est une suite possible d’un épithélio-granulome, possible mais non systématique. Il s’observe à tout âge, aux deux maxillaires (plus au maxillaire supérieur).
Types de kystes péri-apicaux :
- Kyste péri-apical vrai : kyste apical inflammatoire avec une cavité pathologique distincte, bordée par un épithélium, complètement close de telle sorte qu’elle ne communique pas avec le canal.
- Kyste péri-apical en poche : kyste apical inflammatoire comprenant une cavité, en forme de sac, entourée d’un épithélium ouvert et en continuité avec l’apex dentaire.
Pathogénèse :
Au cours de son évolution, le kyste passe par trois phases :
- Phase de latence :
- Kyste petit avec un minimum de symptômes.
- Radiographie : élargissement desmodontal à l’apex, zone de raréfaction osseuse à contours arrondis bien délimités, aspect de la lésion radio-claire.
- Phase de déformation :
- L’extension du kyste se fait silencieusement.
- Kyste vestibulaire : tuméfaction arrondie recouverte d’une muqueuse saine ou à peine hypervascularisée, à la palpation :
- Au début : il reste une épaisseur d’os suffisante pour que la tuméfaction paraisse dure.
- Par la suite, le kyste n’est plus recouvert que par une mince coque osseuse et la palpation donne une sensation d’une balle de celluloïde que l’on refoule et qui revient sur elle-même.
- Kyste palatin : sensations imprécises.
- Phase d’ouverture :
- Dès que le kyste est ouvert, la suppuration est de règle.
Symptomatologie :
- Le kyste est en général asymptomatique tant que son volume ne gêne pas.
- Les poussées inflammatoires se traduisent par l’apparition de douleurs spontanées ou provoquées par la palpation et par l’augmentation du volume kystique avec rougeur et œdème des tissus sous-adjacents.
- Lorsqu’un kyste se développe entre deux dents monoradiculées, un déplacement radiculaire est visible avec un chevauchement coronaire, ce déplacement est presque pathognomonique.
- Absence de réactions aux tests de vitalité.
- La palpation digitale dans la région apicale permet de sentir une voussure fluctuante, donnant à la pression l’impression d’une balle en celluloïde qui se laisse déprimer.
Examen radiographique :
- Épaississement ligamentaire.
- Une géode arrondie à limite nette à fond homogène d’un diamètre supérieur à 1 cm.
- Zone de raréfaction.
- Le trajet fistulaire peut être caractérisé par l’insertion d’un cône de gutta-percha dans l’ostium de sortie de la fistule, permettant ainsi de repérer la dent causale.
Diagnostic différentiel :
Se fait avec toutes les tumeurs bénignes des maxillaires donnant une image radiologique uni ou multiloculaire à contour bien délimité :
- L’abcès parodontal.
- Le granulome apical.
- Améloblastome.
- Angiome.
- Les kystes surinfectés et fistulisés.
- Les ostéites d’origine dentaire.
- Myxome.
- Fibrome.
Diagnostic différentiel entre granulome et kyste :
- Pour certains auteurs, un granulome péri-apical donne une image radiographique moins délimitée (<5 mm) et de radio-clarté moins homogène que les kystes (>5 mm et <10 mm), mais c’est toujours l’anatomie pathologique qui confirme le diagnostic et la ponction qui ramène du liquide kystique jaune citrin, parfois hémorragique dans le cas de kyste, et ne ramène rien dans le cas de granulome.
Diagnostic positif :
Basé sur les signes cliniques :
- Absence de réactions aux tests de sensibilité.
- Absence de symptomatologie clinique.
- La palpation digitale dans la région apicale permet de sentir une voussure fluctuante, donnant à la pression l’impression d’une balle en celluloïde qui se laisse déprimer.
Évolution :
- L’évolution habituelle est l’extension du côté de la zone osseuse de moindre résistance :
- Au maxillaire : refoulement de la paroi sinusienne.
- À la mandibule : refoulement du paquet vasculo-nerveux contenu dans le canal dentaire inférieur.
- Seule la fistulisation arrête l’extension kystique.
- L’infection entraîne une transformation purulente du liquide kystique.
Abcès Péri-Apical Chronique ou Parodontite Apicale Suppurative
Définition :
- C’est une réaction inflammatoire, de faible intensité et de longue durée, du tissu conjonctif péri-apical en réponse à une irritation pulpaire caractérisée par une formation active de pus, drainé à travers une fistule.
- Il peut se développer à partir d’une parodontite apicale chronique ou d’un abcès péri-apical aigu qui a trouvé sa voie d’évacuation à travers la muqueuse buccale.
Aspect histologique :
- Il s’agit d’une région de suppuration très active, entourée de polynucléaires actives et de quelques lymphocytes.
- Le trajet fistuleux est généralement bordé d’un tissu de granulation ou d’un épithélium pavimenteux stratifié.
La fistule :
- C’est le trajet infectieux avec un orifice d’évacuation d’une collection suppurée située dans l’os alvéolaire et venant s’ouvrir directement :
- Soit à la muqueuse gingivale.
- Soit dans une cavité naturelle de la face au niveau du plancher des fosses nasales, sinus ou d’autres régions de la tête et du cou.
- Soit à la peau.
- La collection purulente formée, le périoste est soulevé par le pus, il se perfore ainsi que la muqueuse et le pus s’écoule, il y aura disparition des phénomènes de surpression. Il s’ensuit la régression de la douleur et de la tuméfaction, l’infection passe à la chronicité.
- La fistule siège généralement dans le vestibule sensiblement en face de la dent causale, au niveau de la région apicale.
Voies de drainage du pus :
- Voie trans-canalaire : voie naturelle.
- Voie trans-ligamentaire : rare, détruit le LAD.
- Voie trans-muqueuse : l’abcès s’ouvre spontanément et constitue l’orifice fistuleux muqueux.
- Voie transcutanée : après un trajet osseux, l’abcès suit un trajet plus ou moins long dans le tissu cellulaire, et l’issue de pus peut se faire à la peau.
Symptomatologie clinique :
- L’absence de symptômes est habituelle.
- La fistule est souvent ignorée par le malade.
- La douleur n’apparaît dans l’anamnèse que lors d’épisodes aigus ou subaigus.
- Le patient peut ressentir une très légère sensibilité des dents au choc.
- La dent est légèrement mobile.
- Un épithélium peut obstruer la lumière de la fistule, et la pression consécutive à la formation continuelle de pus provoque des symptômes subaigus : douleurs spontanées continues +/- vives ressenties comme une gêne, localisées à la dent et sensation d’une dent longue, douleurs provoquées par le contact et la pression lors de la mastication.
Radiographie :
- Test du cône de gutta-percha : la présence d’un orifice fistuleux signe l’existence d’un foyer infectieux profond dont on ignore la localisation et l’origine. L’introduction d’un cône de gutta-percha (cône accessoire, calibre fin) dans l’ostium permet de suivre le trajet fistuleux jusqu’à sa source. Une radiographie prise ainsi permettra de localiser cette source : la dent causale et la racine concernée ou une poche parodontale. L’anesthésie n’est pas nécessaire pour réaliser ce test.
Diagnostic différentiel :
- L’abcès parodontal.
- Les kystes surinfectés et fistulisés.
- Les ostéites d’origine dentaire.
Diagnostic positif :
Repose sur :
- L’absence de vitalité pulpaire.
- La présence de fistule qui est le signe pathognomonique d’un abcès péri-apical chronique.
- Radiographie : zone de raréfaction osseuse diffuse et élargissement de l’espace desmodontal.
Évolution :
- Sans traitement, l’abcès peut s’étendre très rapidement aux espaces médullaires osseux adjacents entraînant des complications :
- Locales : fistulisation à la peau, ostéite ou cellulite.
- Générales : septicémie.
Manifestations Périapicales Spécifiques
Pathologie Apicale Transitoire
- Elle correspond à une altération localisée et réversible du péri-apex dont la résolution n’exige pas un traitement endodontique.
- Il s’agit d’une inflammation liée à une agression modérée et stérile dont le retour à la normale s’effectue progressivement après disparition du stimulus.
Actinomycose Péri-Apicale
- Est une forme rare de l’actinomycose cervico-faciale.
- Séquelle de l’infection carieuse, elle est liée à la pénétration endodontique d’Actinomyces israelii et de Propionibacterium.
- La particularité de ces germes est liée à leur faculté de former des colonies filamenteuses typiques, ce qui leur permet d’échapper aux défenses phagocytaires de l’hôte et de survivre en situation extra-radiculaire.
Granulome à Corps Étranger
- Bien que le facteur étiologique principal des parodontites apicales soit microbien, des réactions tissulaires plus spécifiques peuvent se développer en présence de corps étrangers apicaux.
- L’inclusion dans le péri-apex de matériaux étrangers, le plus souvent contaminés, peut initier et/ou perpétuer certaines lésions péri-apicales réfractaires au traitement endodontique.
- Il peut s’agir d’inclusion de particules alimentaires (dents laissées ouvertes), de matériaux introduits lors des préparations canalaires endodontiques (amalgames, ciments, et résines de restauration coronaires, cellulose et pointes de papier, etc.) ou lors de l’obturation endodontique (pâtes et ciments canalaires, cônes de résine, d’argent ou de gutta-percha).
Infection Focale
- Le concept d’infection focale suppose que des microorganismes soient disséminés à partir d’un foyer initial et aient entraîné des métastases locales et systémiques.
Les Complications des LIPOE
Locales
Les infections endodontiques peuvent s’étendre au parodonte et entraîner des complications inflammatoires et infectieuses locales ou locorégionales :
- Périostites.
- Sinusites maxillaires.
- Fistule cutanée.
- Cellulite.
- Lymphadénite : inflammation des ganglions régionaux.
Générales
- Les parodontites constituant des foyers actifs en relation directe avec les voies sanguines et lymphatiques et sont capables d’être la cause d’infections à distance : cardiovasculaires, arthrite rhumatoïde, fièvre générale inexpliquée.
- Les foyers infectieux dentaires peuvent intervenir dans la genèse des endocardites bactériennes greffées.
- Il existe des relations entre les foyers dentaires et la pathologie rénale, articulaire, et cutanée par le biais de processus immunologiques.
Conclusion
Les LIPOE, séquelles de l’infection endodontique, sont des pathologies désormais bien comprises. De nature inflammatoire, elles traduisent le combat dynamique qui oppose les facteurs bactériens intra-canalaires et les facteurs de défense péri-apicaux. L’auto-guérison est impossible et la destruction des tissus péri-apicaux progresse tant que l’infection endodontique n’est pas jugulée. Le concept moderne du traitement des LIPOE réside dans la conservation de la dent causale après désinfection de son endodonte.
Lésions Inflammatoires Périapicales d’Origine Endodontique (LIPOE) / OCE
La santé bucco-dentaire est essentielle pour le bien-être général, nécessitant une formation rigoureuse et continue des dentistes. Les étudiants en médecine dentaire doivent maîtriser l’anatomie dentaire et les techniques de diagnostic pour exceller. Les praticiens doivent adopter les nouvelles technologies, comme la radiographie numérique, pour améliorer la précision des soins. La prévention, via l’éducation à l’hygiène buccale, reste la pierre angulaire de la pratique dentaire moderne. Les étudiants doivent se familiariser avec la gestion des urgences dentaires, comme les abcès ou les fractures dentaires. La collaboration interdisciplinaire avec d’autres professionnels de santé optimise la prise en charge des patients complexes. La santé bucco-dentaire est essentielle pour le bien-être général, nécessitant une formation rigoureuse et continue des dentistes.



Leave a Reply