Les lésions inflammatoires péri -apicales d’origine endodontique
Les lésions inflammatoires péri -apicales d’origine endodontique
1. Introduction :
Les parodontites apicales, d’après LASFARGUES et MACHTOU :
Sont des lésions inflammatoires du parodonte profond péri-radiculaire, principalement de la région périapicale, consécutives à l’infection bactérienne de l’endodonte provoquée par une agression infectieuse, mécanique et chimique.
La décontamination du système endodontique, sa mise en forme et son obturation étanche sont les seuls garants permettant d’éradiquer l’infection du périapex.
Cette réaction inflammatoire est favorisée par la continuité anatomique et conjonctive qui existe au niveau des voies de passage naturelles foraminales, entre d’une part l’espace canalaire pulpaire et d’autre part l’espace desmodontal.
2- Rappels anatomiques de la région apicale :
Les tissus du péri-apex sont l’ensemble des tissus minéralisés ou non qui assurent la fixation et de la dent dans son alvéole. Il comprend l’os alvéolaire qui circonscrit la racine de la dent, le cément, tissu minéralisé tapissant la racine dentaire, et le ligament parodontal. C’est un tissu conjonctif lâche parcouru par de nombreux faisceaux et fibres collagènes et élastique.
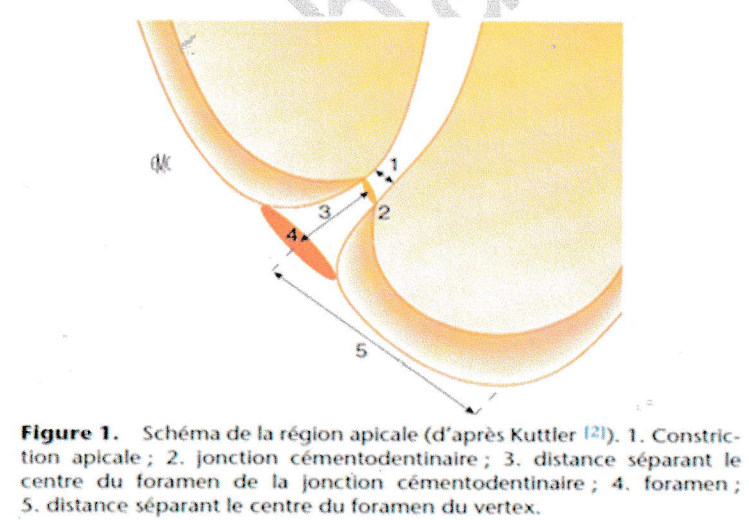
Kuttler a montré que cette région est constituée de deux cônes l’un dentinaire, l’autre cémentaire qui s’opposent par leurs sommets dans la partie dentinaire le canal se rétrécit jusqu’à le JDC et s’élargit à nouveau dans sa partie cémentaire jusqu’au foramen.
L’espace de Black est délimité par le cône cémentaire et la lame cribliforme de l’os alvéolaire.
Figure 1. Schéma de la région apicale (d’après Kuttler (2)).
- Constriction apicale ; 2. jonction cémentodentinaire ; 3. distance séparant le centre du foramen de la jonction cémentodentinaire ; 4. foramen ; 5. distance séparant le centre du foramen du vertex.
3- Étiologies des pathologies péri-apicales :
3-1- Les causes infectieuses :
C’est l’infection pulpaire la gangrène pulpaire (à une carie, traumatisme…),
Des manœuvres intempestives (des piqûres septiques, de refoulement des débris infectés, des fausses routes, des fractures d’instruments non stériles au-delà de l’apex).
Le manque d’étanchéité apicale et coronaire (la percolation).
3-2- Les causes physiques :
Elles sont exclusivement d’ordre mécanique.
- Les traumatismes (contusions, luxations).
- Les accidents thérapeutiques endodontiques pendant le traitement radiculaire (débordement de pâtes).
- Troubles de l’occlusion des restaurations coronaires mal équilibrées.
3-3- Les causes chimiques :
Elles sont médicamenteuses et relèvent des thérapeutiques endodontiques.
Toutes substance utilisée dans ces traitements est susceptible de déterminer une réaction périapicale si son application ou sa dose n’est pas judicieusement respectée ; que ce soit l’anhydride arsénieux ; le formol, les essences, l’hypochlorite de sodium. Toutefois ; il faut considérer un double problème : celui de la toxicité du médicament et de la tolérance du malade.
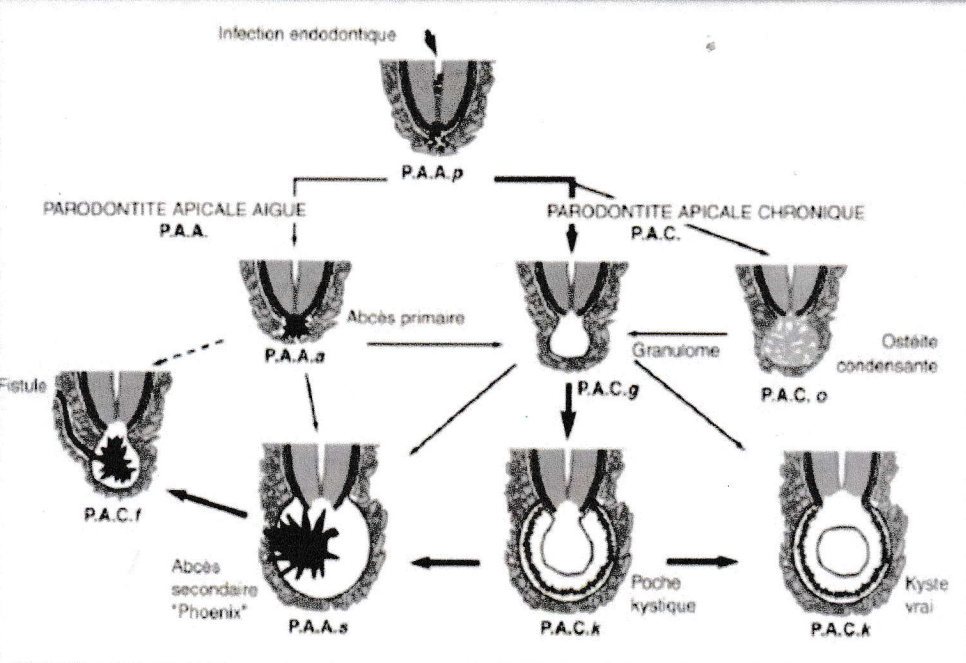
4- Terminologie et classification :
Une certaine confusion sémantique règne pour désigner les complications périapicales des pulpopathies et témoigne de la mauvaise compréhension des phénomènes histopathologiques caractérisant les parodontites apicales. La classification internationale des maladies adaptée à l’odontostomatologiste distingue les diverses entités pathologiques.
Une classification simplifiée classant les parodontites apicales (PA) selon la nature aiguë ou chronique de la ligne pathogénique paraît plus adaptée à l’exercice clinique tout en étant conforme à la dynamique inflammatoire de ces lésions.
La classification de FS. Weine :
1- Pathologies pulpo-péri-apicales symptomatiques :
- PAA : parodontite apicale aiguë « forme commençante ou exsudative »
- PAA : parodontites apicale aiguë « forme avancée ou suppurative » :
- Abcès péri-apical aigu.
- Abcès recrudescent ou « phœnix ».
- Abcès péri-apical subaigu.
2- Pathologies pulpo-péri-apicales asymptomatiques :
- Pulpo-ostéosclérose péri-apicales : ostéite condensante.
- Parodontite apicale chronique forme commençante.
- Parodontite apicale chronique forme avancée :
- Granulome péri-apical ; parodontite péri-apicale proliférative.
- Kyste péri-apical ; parodontite péri-apicale proliférative.
- Abcès péri-apical chronique : parodontite péri-apicale suppurative.
| Classification dynamique des auteurs | Abréviation | Classification de l’O-ALS | Dénominations courantes |
|---|---|---|---|
| Parodontites apicales aiguës | PAA | Périodontite apicale aiguë | desmodontite |
| Parodontite apicales aiguë primaire débutante puis installée | PAAp | Périodontite apicale aiguë d’origine pulpaire | Desmodontite, desmodontite aiguë, pulpodesmodontite |
| Parodontite apicale aiguë primaire abcédée | PAAa | Abcès péri-apical sans fistule | Abcès dentaire, abcès péri-apical primaire |
| Parodontite apicale aiguë secondaire | PAAa | Abcès péri-apical | Flambée apicale, abcès secondaire, abcès alytolodentaire, abcès phœnix |
| Parodontites apicales chroniques | PAC | Périodontite apicale chronique | Granulome et kyste |
| Parodontite apicale chronique | PACs | Granulome apical | Granulome dentaire et épithéliogranulome |
| Parodontite apicale chronique kystique : – poche kystique – kyste vrai | PACk | Kyste radiculaire comprend : kyste radiculaire apical et latéral résiduel, paradental, inflammatoire | Kyste d’origine dentaire, kyste apical, kyste en baie, … |
| Parodontite apicale chronique avec fistule | PACs | Abcès péri-apical avec fistule s’ouvrant dans le sinus maxillaire, la fosse nasale, dans la cavité buccale | Granulome avec fistule, abcès dentaire avec fistule, abcès récurrent… |
| Parodontite apicale chronique – avec ostéite condensante – avec hypercémentose | PACe | Maladies de la pulpe et des tissus péri-apicaux, autres et sans précision | Ostéosclérose péri-radiculaire, ostéomyélite sclérosante, hyperplasie cémentaire |
5- Bactériologie :
La flore microbienne est variée, mais non spécifique.
La flore microbienne comporte des aérobies, des anaérobies facultatifs et des anaérobies stricts.
En résumé, les espèces les plus fréquemment isolées étaient :
- Les coques (Streptocoques, Peptostreptocoques, Veillonella).
- Les bacilles (Fusobacterium, Actinomyces, Prevotella, Porphyromonas).
- Les coques à Gram positif et les bacilles à Gram négatif étaient prédominants.
- Les levures comme Candida jouent un rôle dans les infections endodontiques.
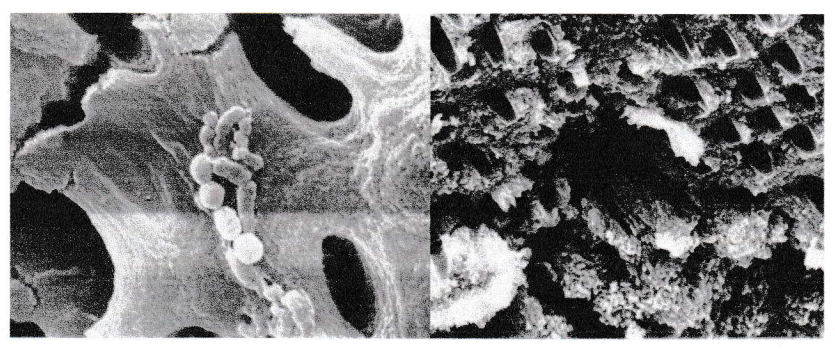
Bacilles et cocci sur la paroi canalaire et pénétrant les tubuli (microscope électronique à balayage).
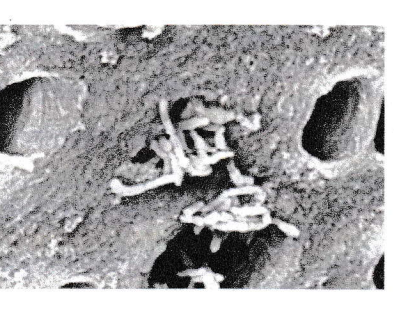
Prevotella intermedia à l’entrée des tubuli (microscope électronique à balayage).
6- Pathogénie des lésions apicales :
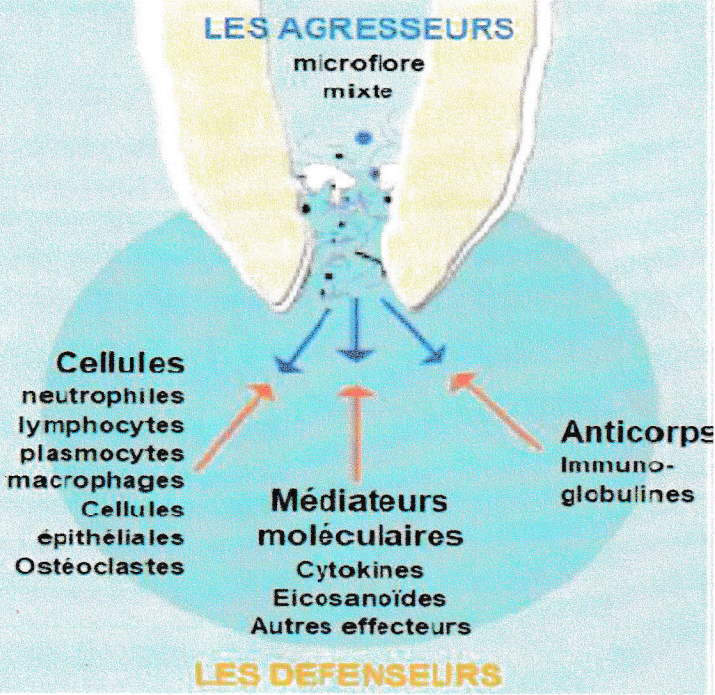
La parodontite apicale est le résultat d’une réaction inflammatoire à double tranchant défensive et agressive, c’est comme un combat dynamique entre l’agent agresseur de la pulpe intracanalaire et la défense de l’hôte dans le péri-apex.
6-1- Les facteurs d’agression :
La flore bactérienne endodontique génère plusieurs types d’effets délétères en fonction de la pathogénicité et de la virulence des espèces en cause. Les sous-produits bactériens libérés dans le canal et migrant dans le périapex sont fortement impliqués :
- Les enzymes protéolytiques : favorisent la pénétration tissulaire des micro-organismes. Certaines enzymes détruisent les complexes immuns et rendent indisponibles les anticorps nécessaires à la défense humorale et cellulaire.
- Les exotoxines : sont des molécules toxoïdes très antigéniques, telle la leucotaxine qui lyse les membranes des leucocytes.
- Les endotoxines : sont des macromolécules pyrétiques provenant en particulier de la désintégration des membranes des bactéries Gram négatif.
- Les lipopolysaccharides (LPS) : exercent des effets pathogènes directs ou indirects, impliquant la production de cytokines, de prostanoïdes et d’autres médiateurs.
Ainsi, avec le temps une flore agressive (action protéolytique), anaérobie et équipée contre les facteurs de défense (résistance à la phagocytose), colonise la portion apicale du canal et assiège les tissus vivants périapicaux qui sont progressivement détruits.
6-2- Les facteurs de défense de l’hôte :
Les cellules :
- Les cellules de défense constituent environ la moitié de la population cellulaire des lésions périapicales. Cette population cellulaire est plus dense dans les granulomes que dans les kystes. Le rapport entre les différents types de cellules varie avec le temps. Les neutrophiles prédominent dans les phases aiguës alors que les lymphocytes B et T et les macrophages s’accumulent dans les phases chroniques. L’afflux des PMNs neutrophiles est très précoce et constitue la première ligne de défense cellulaire périapicale. Les lymphocytes T et les macrophages prédominent sur les lymphocytes B. Les différentes sous-populations de cellules T sont les CD4+, CD8+, CD11+.
- Les cellules épithéliales de Malassez peuvent proliférer jusqu’à représenter 50% de la population cellulaire des lésions, dans les kystes comme dans les granulomes. Ces cellules normalement quiescentes peuvent être stimulées au cours du processus inflammatoire par les cytokines et les facteurs de croissance. Elles forment alors des proliférations épithéliales qui participent à la pathogénèse des kystes apicaux. Ces cellules épithéliales sont fréquentes au niveau des molaires maxillaires et l’épithélium du sinus a été suggéré comme une source possible.
Les médiateurs et effecteurs moléculaires :
Les cellules activées lors de la réaction inflammatoire produisent une multitude de messagers intercellulaires qui agissent en synergie avec, pour mission, l’inactivation et la destruction des pathogènes.
- Les dérivés de l’acide arachidonique, les prostanoides et les leucotriènes : Les prostaglandines (PGs) sont des facteurs de vasodilatation et d’activation des ostéoclastes.
- Les amines vaso-actives, les kinines, les neuropeptides : L’innervation périapicale intervient dans la modulation de l’inflammation neurogénique via la libération des neuropeptides.
- Les métalloprotéinases : Elles ont été mises en évidence dans les parois des kystes. Elles dégradent les matrices extracellulaires construites sur les réseaux de collagène et participent à la progression des lésions.
- Les cytokines : Elles incluent de nombreux messagers intercellulaires tels que l’interleukine (IL), l’interféron, des facteurs cytotoxiques et les facteurs de croissance. Stimulent l’infiltration de la lésion péri-apicale par les leucocytes et les monocytes.
- Les anticorps (Ig) : Sont produits par les plasmocytes en réponse aux antigènes bactériens : surtout IgG (70%) puis IgA, IgE et IgM. La concentration d’IgG est multipliée par 5 dans les granulomes, on les retrouve aussi dans les parois et les cavités des kystes apicaux.
6-3- La réponse initiale aiguë et exacerbation primaire :
Il s’agit d’une réponse de l’hôte intense et de courte durée. Cette réponse initiale aiguë peut être initiée par les bactéries du canal infecté, mais aussi par un traumatisme ou une lésion iatrogénique (dépassement de l’instrumentation, irritation chimique ou mécanique du matériel endodontique). Elle est caractérisée par une hyperhémie, une congestion vasculaire, un œdème du desmodonte, une extravasation des neutrophiles et des monocytes et une résorption osseuse limitée. Histologiquement, les modifications tissulaires sont limitées à l’espace desmodontal périapical et à l’os néoformé voisin. La dent est sensible ou douloureuse à la pression. La lésion n’est pas obligatoirement détectable par la radiographie. Toutefois, la réaction ostéoclastique est rapidement déclenchée par l’accumulation des médiateurs et peut intervenir avant la nécrose totale de la pulpe.
Ceci explique la présence possible d’images apicales radioclaires alors qu’il persiste un tronçon apical pulpaire vital. Au stade aigu initial, plusieurs voies sont possibles :
- La guérison spontanée (uniquement les inflammations aseptiques),
- L’amplification de l’inflammation et la formation d’un abcès primaire,
- L’abcédation et la fistulisation,
- L’évolution vers la chronicité : granulomes et kystes.
6-4- La transformation chronique et exacerbation secondaire :
La présence continue d’irritants dans le canal favorise graduellement le passage de l’inflammation initiale vers une lésion encapsulée par un tissu conjonctif collagénique contenant de plus en plus de macrophages et lymphocytes, produisant des anticorps et des cytokines. Au cours de cette transformation, les cytokines vont orienter le statut de la lésion, tantôt en stimulant les facteurs d’activation des ostéoclastes et en favorisant la résorption osseuse, tantôt en favorisant les facteurs de croissance stimulant la prolifération des fibroblastes et l’angiogénèse, la reconstruction du conjonctif et le ralentissement de la résorption. Les cellules T helper de type 1 et 2 sont impliquées dans ce processus inhibiteur de la destruction osseuse.
Ainsi le granulome reflète un stade d’équilibre entre les agresseurs confinés dans le canal et une défense autocontrôlée. Il peut rester au repos et sans symptômes pendant plusieurs années et sans modification radiographique décelable.
À tout moment, ce fragile équilibre peut être rompu, les bactéries avancent à la lisière du périapex et déclenchent une exacerbation aiguë, sous forme d’abcès secondaires mieux connus sous les noms d’abcès phœnix ou récurrents. La résorption osseuse reprend et on observe un élargissement de la zone radioclaire. Ainsi, la progression de l’inflammation n’est pas linéaire, mais discontinue avec alternance de poussées aiguës de courte durée au sein de la phase chronique s’étalant sur des années.
7- Les formes cliniques :
7-1- Les parodontites apicales aiguës :
7-1-1 La parodontite apicale aiguë primaire :
À un stade débutant :
Elle correspond au passage initial de l’inflammation pulpaire dans le péri-apex. La douleur est spontanée et provoquée par le contact de la dent.
La dent est sensible à la pression et reconnue par le patient (à la percussion).
La réponse aux tests de vitalité est encore positive, notamment sur les dents pluri radiculées (persistance de tissu pulpaire vital).
À un stade avancé :
Correspond à une inflammation exsudative sévère dans le péri-apex en rapport avec la pénétration de germes dans la cavité pulpaire. La pulpe est nécrosée et la douleur est spontanée.
La dent devient très douloureuse à la percussion et la palpation en regard de l’apex est généralement sensible.
7-1-2-La parodontite apicale primaire abcédée (abcès périapical aigu primaire) :
- Elle correspond à une suppuration localisée au péri apex.
- La pulpe est nécrosée, la douleur spontanée et permanente.
- C’est le stade le plus douloureux. Le contact de la dent est intolérable et la percussion doit être évitée.
- La palpation en regard de l’apex est douloureuse.
- Un abcès périapical aigu n’est pas obligatoirement visible radiographiquement (abcès entièrement intra-osseux).
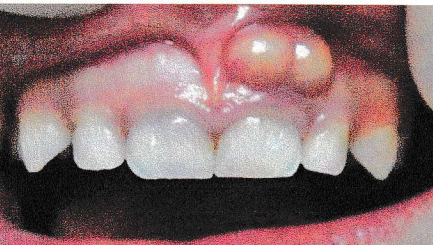
7-1-3-La parodontite apicale aiguë secondaire abcédée (Abcès périapical secondaire, abcès Phoenix) :
Elle correspond à l’exacerbation d’une lésion chronique préexistante. Les symptômes sont sensiblement voisins de ceux de l’abcès primaire avec une caractéristique : une image radio-claire est toujours décelable du fait de la destruction osseuse préexistante.
Elle correspond à l’exacerbation d’une lésion chronique préexistante. Les symptômes sont sensiblement voisins de ceux de l’abcès primaire avec une caractéristique : une image radio-claire est toujours décelable du fait de la destruction osseuse préexistante.

7-2-Les parodontites apicales chroniques :
7-2-1- Les parodontites apicales chroniques granulomateuses :
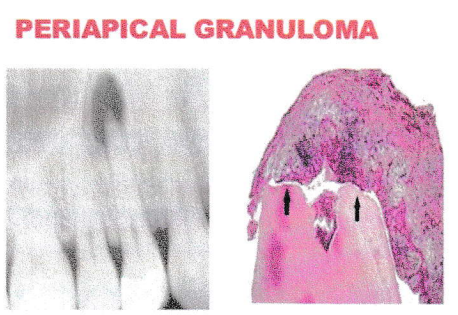
Définition :
Selon WEINE : « le granulome périapical est une réaction caractérisée par la formation d’un tissu granulomateux périapical en réponse à une irritation continue et par une capsule périphérique de fibres de collagènes. C’est une pseudotumeur inflammatoire d’origine dentaire, représentant une réaction inflammatoire hyperplasique du tissu conjonctif desmodontal. Il constitue un tissu réactionnel de défense vis-à-vis une infection latente et pouvant évoluer vers la formation d’un kyste. »
Alors ici on conclut que le granulome est un environnement défavorable pour les bactéries. Cette lésion péri-apicale constitue un environnement plus propice à la destruction qu’à la prolifération bactérienne. Il reflète un stade d’équilibre entre l’agent pathogène dans le canal et la défense autocontrôlée ce qui peut rester plusieurs années asymptomatique et sans modifications radiologiques.

Symptomatologie :
Signes subjectifs : Il n’existe pas une symptomatologie subjective sinon une gêne mal localisée, avec parfois une sensation de dent longue et une sensibilité à la pression sur la dent et de la région apicale.
Signes objectifs :
- Les tests de vitalité pulpaire sont négatifs.
- À la percussion axiale, la dent est légèrement sensible.
- La percussion transversale peut être perçue, par la pulpe de l’index placé dans le vestibule, au niveau de l’apex de la dent, comme un choc en retour.
Une image radioclaire le plus souvent périapicale, développée aux dépens de l’os alvéolaire, avec disparition de la lamina dura. Son diamètre ne dépasse pas 5 mm.
PERIAPICAL GRANULOMA
7-2-2-La parodontite apicale chronique kystique :
Les kystes radiculo-dentaires sont une réponse inflammatoire du péri-apex, qui se développe à partir de lésions chroniques avec préexistence de tissu granulomateux. (Transformation du granulome en kyste). On distingue :
- Les kystes vrais : lorsque la cavité kystique entièrement circonscrite par une membrane épithéliale est isolée de la lumière canalaire ;
- Des poches kystiques : lorsque la lumière canalaire apicale est en continuité avec la partie épithélialisée du kyste.
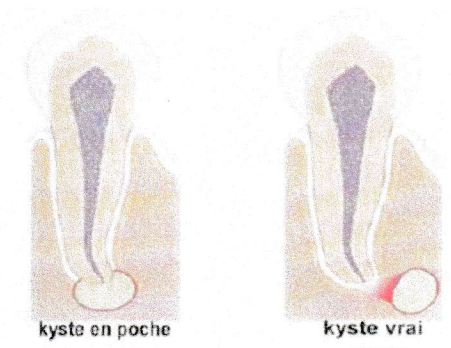
kyste en poche
kyste vrai
La pathogenèse d’un vrai kyste suppose trois étapes :
- Première phase : les résidus épithéliaux de Malassez, quiescents, commencent à proliférer sous l’influence de facteurs de croissance : le EGF « epidermal growth factor » et le PDGF « facteur de croissance dérivé des plaquettes » libérés par les cellules résidentes activées.
- Deuxième phase : une cavité bordée par un épithélium se développe.
- Troisième phase : le kyste augmente de volume.
Le rôle de la pression osmotique semble négligeable. L’expansion du kyste est plus probablement due à l’activité des agents moléculaires de résorption osseuse, produits par les cellules résidentes du kyste et qui diffusent vers la périphérie osseuse : cytokines, métalloprotéases.
Pathogenèse des poches kystiques (ou kystes en baie) :
1- Une barrière de neutrophiles s’installe à l’apex pour contenir les germes intracanalaires. Avec le temps, les neutrophiles s’accumulent et forment un bouchon apical.
2- Les cordons épithéliaux prolifèrent en périphérie et réalisent un attachement épithélial aux parois radiculaires, isolant le bouchon apical de neutrophiles.
3- Le bouchon continue à croître. Lorsqu’il se désintègre, une micro-poche se forme puis s’élargit, formant un diverticule du canal en forme de sac confiné à l’intérieur de la lésion.
4- L’expansion de la poche kystique et l’activité de la lésion sont identiques à celles du kyste vrai.
Symptomatologie :
Le kyste est en général sans symptômes, tant que son volume ne devient pas une gêne. Cependant il peut y avoir des poussées inflammatoires qui se traduisent par l’apparition de douleurs spontanées ou provoquées par la palpation.
- Une voussure palpable.
- L’absence de réaction aux tests de vitalité.
- Image péri-apicale radioclaire de destruction osseuse.
La croissance des lésions peut entraîner une version, migration, un chevauchement et une mobilité repérable cliniquement. Ponction peut ramener un liquide jaune citrin avec la présence de cristaux de cholestérol.

7-2-3-La parodontite apicale chronique avec fistule :
La fistule est définie comme une voie de drainage extériorisée des fluides inflammatoires apicaux de contenu pyogénique présent au niveau péri-apical.
- Elle est asymptomatique.
- Réponse négative aux tests de sensibilité pulpaire.
- Image péri-apicale radioclaire de destruction osseuse.
Le trajet et l’émergence de la fistule sont aléatoires ; c’est la raison pour laquelle l’origine de la lésion doit être localisée à l’aide d’une radiographie prise après introduction d’un cône de gutta-percha dans la fistule.
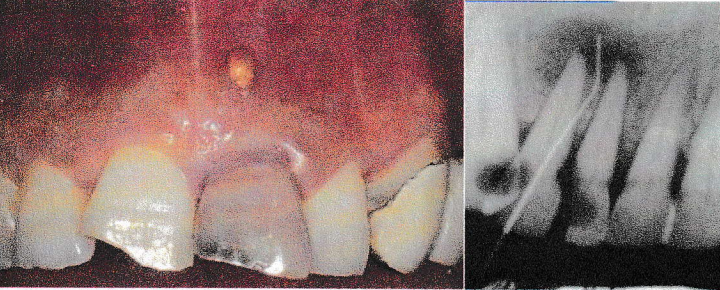
7-2-3-Ostéite condensante : pulpo-ostéo-sclérose péri-apicale, Ostéomyélite sclérosante
Définition : C’est une réponse proliférative de l’os périapical suite à une irritation pulpaire de faible intensité et de longue durée. C’est une inflammation chronique du péri-apex avec une image caractéristique de radiodensité apicale résultant de l’activité ostéoblastique au lieu de la résorption associée à l’inflammation périapicale.
Cette forme est rencontrée typiquement chez les personnes jeunes, autour des apex des dents inférieures portant de grandes lésions carieuses et une pulpe en état inflammatoire chronique.
- Dent asymptomatique.
- Réponse négative aux tests de sensibilité pulpaire.
- L’examen radiologique montre une opacité circonscrite de l’apex de la dent causale (hyper-condensation osseuse).

8-Le diagnostic des parodontites apicales :
Les trois critères clés permettant de poser un diagnostic de parodontite apicale sont l’existence d’une voie de contamination bactérienne, une réponse négative aux tests de vitalité pulpaire et une image osseuse radioclaire d’origine endodontique. Un examen clinique bien conduit permet de diagnostiquer la parodontite apicale.
L’interrogatoire :
Le premier temps, permet surtout de savoir les antécédents généraux du malade à savoir toute pathologie qui contre-indique le traitement endodontique ou qui nécessite une attitude thérapeutique spéciale (un contact avec le médecin traitant par exemple), il permet également de recueillir le ou les motifs de consultation du patient qui peuvent en grande partie nous guider.
L’examen clinique :
A- L’inspection et la palpation en exo et en endo buccal pour objectiver notre travail :
- Exo buccal : l’inspection peut révéler la présence d’une fistule négligée par le patient, une asymétrie faciale suite à tuméfaction d’origine endodontique alors que la palpation détecte l’existence d’un ganglion.
- Endo buccal : l’inspection de l’hygiène, modification de teinte, présence d’un abcès, une fistulisation oriente le praticien vers la présence d’une réaction péri-apicale.
Signes dentaires : perte de substance (carie, traumatisme …etc.), changement de la teinte (dent grisâtre suite à sa nécrose), une restauration défectueuse, les anomalies dentaires congénitales et acquises.
B- La palpation :
- Exo buccale : présence d’une adénopathie en rapport avec la dent causale.
- Endo buccale : palpation de fond de vestibule révèle une sensibilité. Une douleur.
- Signes muqueux : aspect inflammatoire des tissus mous, ostium fistulaire, abcès avec ou sans fistule.
- Signes fonctionnels : mobilités pathologiques, des interférences (microtraumatismes).
C- Signes subjectifs :
C-1- Douleurs spontanées :
- Caractère : continue, elle commence progressivement et s’installe pour ne plus cesser, la douleur ne cesse pas, il n’y a jamais de rémission totale, elle résiste bien aux antalgiques courants.
- Intensité : elle est variable selon l’état de congestion, allant du simple gêne à la douleur intolérable.
- Localisation : le plus souvent localisée.
C-2- Douleurs provoquées :
Par la pression, une percussion, une légère mobilité.
Les tests cliniques :
Les signes objectifs orientant notre démarche diagnostique sont :
- Test de sensibilité pulpaire : Toute réponse négative aux tests thermiques, électriques, ou de fraisages signe une pulpe nécrosée.
- Test de percussion : Il se fait légèrement et axialement à l’aide d’un manche d’instrument, elle diffère selon la forme clinique de la PA.
La palpation de fond de vestibule à l’aide de la pulpe de l’index à la recherche d’une zone sensible, douloureuse ou de consistance anormale, qui renseignent parfois la présence d’une collection purulente, d’un état inflammatoire, et dans certains cas la destruction des corticales osseuses externes.
d- Examen radiographique :
C’est l’étape clé du diagnostic, révélant ou confirmant une lyse osseuse péri-apicale spécifique de la PA.
Les critères classiques du diagnostic radiologique de la lésion apicale sont :
- Le changement de la structure osseuse.
- L’augmentation de volume de l’espace radiolaire desmodontal, communément désigné “épaississement du desmodonte”.
- L’interruption de la lamina dura.
- La présence d’une image radiolaire.
e- Diagnostic différentiel :
Le diagnostic différentiel des lésions péri-apicales peut être posé avec les lésions suivantes :
- Les pulpopathies.
- Lésion d’origine marginale : elle est distinguée de la lésion endodontique vraie par son drainage par voie parodontale (fistule desmodontale).
- La fracture verticale : l’examen clinique et le sondage caractéristique symétrique sont déterminants pour poser le diagnostic.
- L’ostéomyélite.
- Le kyste parodontal.
9- Conclusion :
Il fut un temps où les dents atteintes d’une lésion péri-apicale étaient extraites. Les moyens d’investigation pour établir un diagnostic précis, ainsi que les méthodes de traitement étaient limités.
De nos jours malgré le nombre élevé de nos patients, il est possible en associant des méthodes préventives contre les caries et les anomalies dentaires, aux moyens dont dispose la thérapeutique endodontique moderne d’avoir des résultats très satisfaisants et moins mutilants pour le patient.
Les lésions inflammatoires péri -apicales d’origine endodontique
Voici une sélection de livres:
Odontologie conservatrice et endodontie odontologie prothètique de Kazutoyo Yasukawa (2014) Broché
Concepts cliniques en odontologie conservatrice
L’endodontie de A à Z: Traitement et retraitement
Guide d’odontologie pédiatrique, 3e édition: La clinique par la preuve



Leave a Reply