ÉTIOLOGIE DES MALADIES PARODONTALES
ÉTIOLOGIE DES MALADIES PARODONTALES
Introduction
Les maladies parodontales sont des infections bactériennes mixtes qui entraînent la destruction des tissus de support de la dent. Trois espèces bactériennes à Gram négatif retrouvées dans la plaque dentaire, soit Porphyromonas gingivalis, Bacteroides forsythus et Actinobacillus actinomycetemcomitans, ont pu être fortement associées à ces maladies. La réponse immunitaire de l’hôte, en réponse à l’agression bactérienne constante, est un facteur déterminant dans la progression de la maladie.
Les facteurs étiologiques des maladies parodontales sont tous les facteurs qui provoquent, interviennent ou contribuent d’une manière quelconque au développement d’une lésion ou à la destruction du tissu parodontal. On classe ces facteurs en facteurs locaux, représentés essentiellement par le biofilm bactérien dentaire, et en facteurs généraux.
1. Santé Parodontale
État stable dans le temps de l’ensemble des quatre tissus parodontaux :
- Gencive
- Ligament parodontal (desmodonte)
- Cément
- Os alvéolaire
qui adhèrent et/ou s’attachent sur la surface entière de la racine dentaire. La partie la plus coronaire de cette attache se trouve à la jonction amélo-cémentaire (JAC).
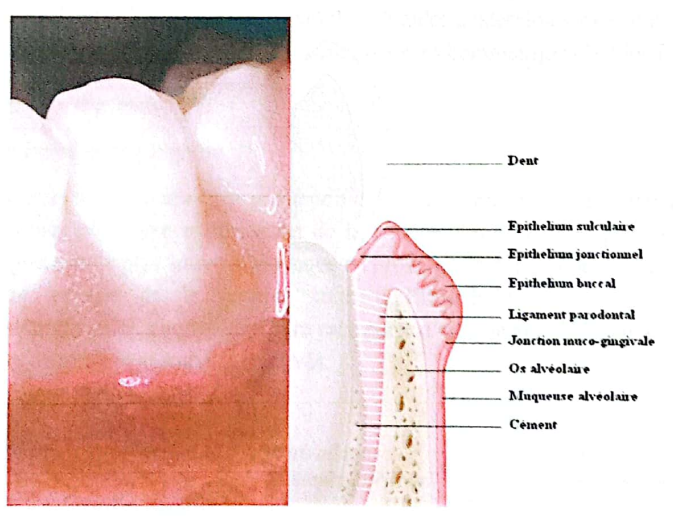
Parodonte Sain
La santé parodontale est un état exempt de maladies parodontales inflammatoires. Elle se détermine par l’absence clinique des signes des maladies parodontales. Le parodonte sain se caractérise par :
- Une gencive de couleur rose corail ;
- Une absence de saignement (spontané ou au brossage) ;
- Un contour gingival fin et festonné harmonieux ;
- Une absence de perte d’attache ;
- Une absence de poches parodontales ;
- Une absence de récessions parodontales.
2. Les Maladies Parodontales
2.1. Définition des Maladies Parodontales
Les maladies parodontales sont définies comme étant des maladies inflammatoires multifactorielles d’origine bactérienne : ce sont donc des infections dont l’étiologie primaire se situe dans le biofilm dentaire, encore appelé “plaque dentaire” (HAS, 2002). Il existe deux grandes familles de maladies parodontales : les gingivites et les parodontites.
- Gingivites : Elles se caractérisent par la seule atteinte de la gencive et par leur caractère réversible dès lors que l’étiologie est supprimée.
- Parodontites : Elles affectent l’ensemble des structures tissulaires parodontales, entraînant des pertes d’attache, c’est-à-dire des lésions tissulaires osseuses (alvéolyse), cémentaires et desmodontales, qui ont un caractère irréversible. Si le traitement étiologique des parodontites permet dans de très nombreux cas de stabiliser l’évolution de la maladie, il ne permet pas de réparer à lui seul les lésions tissulaires profondes.
2.2. Données Épidémiologiques
Les maladies parodontales sont répandues dans les pays développés et en développement et affectent environ 20 à 50 % de la population mondiale. La forte prévalence de la maladie parodontale chez les adolescents, les adultes et les personnes âgées en fait un problème de santé publique. Cette augmentation représente les effets cumulatifs d’exposition à la plaque dentaire plutôt qu’une incidence élevée attribuable à l’âge. Un grand nombre d’études épidémiologiques ont démontré une plus importante prévalence de maladies parodontales chez les hommes que chez les femmes.
2.3. Caractéristiques Cliniques
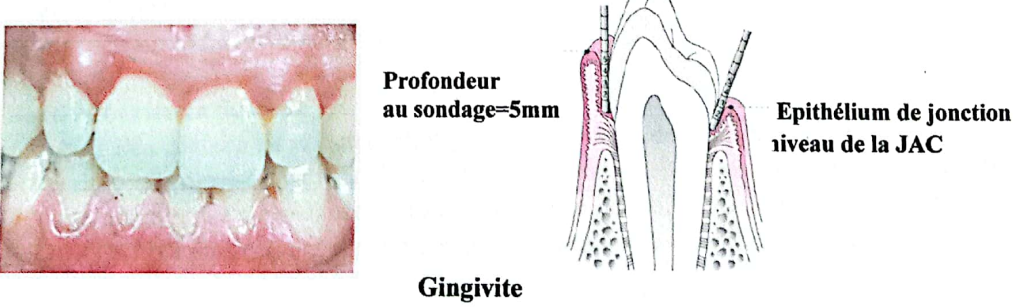
2.3.1. Signes Cliniques de la Gingivite
Cliniquement, la gingivite se traduit par une modification de la morphologie gingivale :
- Une rougeur ;
- Une perte de consistance et une modification de la texture gingivale (la gencive devient lisse et brillante) ;
- Un saignement, le plus souvent provoqué au brossage dentaire ou lors de la mastication ;
- Une augmentation du volume de la gencive suite à l’installation d’un œdème, aboutissant à l’approfondissement du sillon gingivo-dentaire sans perte d’attache, appelé “poche gingivale” ;
- De la plaque dentaire et du tartre sont souvent observés.
2.3.2. Signes Cliniques de la Parodontite
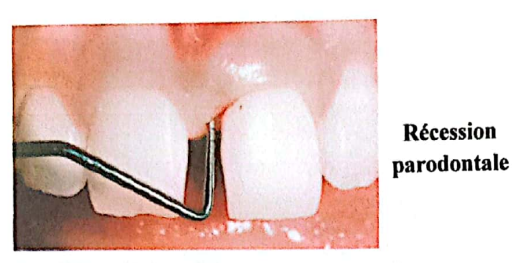
Une parodontite se caractérise par :
- Une perte d’attache plus ou moins importante et plus ou moins généralisée ;
- La formation de poches parodontales : approfondissement du sillon gingivo-dentaire suite à la perte d’attache ;
- Une lyse osseuse alvéolaire (alvéolyse) ;
- Des signes d’inflammation de la gencive ;
- Une mobilité et une migration dentaire, conséquences de la perte d’attache, qui peuvent aboutir dans certains cas, notamment dans les formes agressives de parodontites et en l’absence de traitement, à l’expulsion des dents ;
- Moins fréquemment, une halitose et une suppuration sont retrouvées.
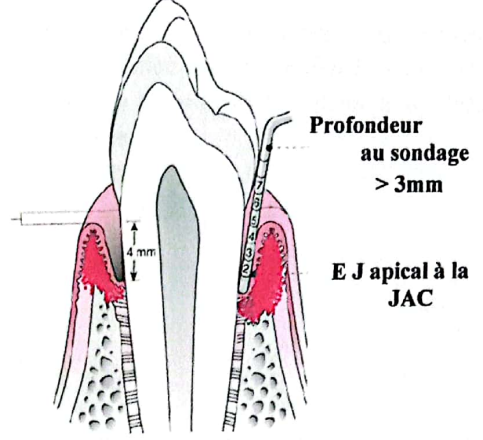
Exemple de Diagramme (Côté Buccal) :
- Récession = 1 mm
- Profondeur au sondage = 4 mm
- Perte d’attache clinique = 5 mm
2.4. Les Facteurs de Risque
Les maladies parodontales résultent de plusieurs facteurs, notamment des facteurs de risque spécifiques au patient et une hygiène bucco-dentaire inadéquate. Les facteurs de risque peuvent être subdivisés en :
- Facteurs de risque modifiables : tabagisme, mauvaise hygiène bucco-dentaire, diabète sucré, grossesse ;
- Facteurs de risque non modifiables : âge, hérédité (y compris les maladies génétiques).
3. Facteurs Locaux
Ce sont les facteurs retrouvés dans l’environnement immédiat des tissus parodontaux.
3.1. Facteurs Directs
Ils sont représentés par les dépôts exogènes.
3.1.1. Biofilm Bactérien Dentaire
Le biofilm bactérien dentaire est le facteur étiologique déclenchant des maladies parodontales. La cavité buccale est colonisée par l’une des communautés microbiennes les plus importantes du corps humain. Cette microflore est constituée de bactéries à Gram positif, généralement commensales, et à Gram négatif, généralement pathogènes, organisées en une structure complexe appelée « biofilm ».
3.1.1.1. Définition
Le biofilm se définit comme une accumulation de micro-organismes, de différentes espèces, adhérant à une surface généralement en relation avec un environnement aqueux (Gracieux, Robert, Bonnaure-Mallet, 2006).
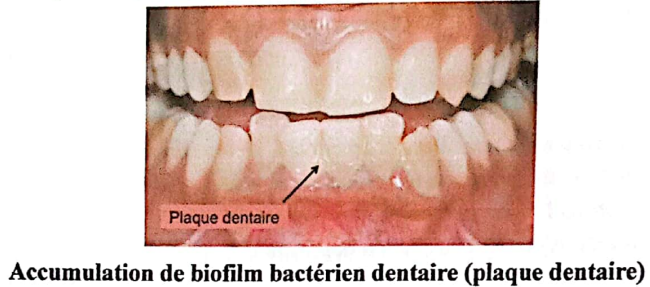
Dans la cavité buccale, les surfaces dentaires et gingivales baignent en permanence respectivement dans la salive et le fluide gingival qui représentent donc le milieu humide et chaud, permettant la croissance d’une remarquable collection de microorganismes, à l’origine de la formation du biofilm (Marsh et Martin, 2009). Celui-ci est alors appelé plaque dentaire.
Accumulation de biofilm bactérien dentaire (plaque dentaire)
3.1.1.2. Formation
L’adhérence des bactéries sur une surface dentaire permet la formation d’une communauté organisée, intime, multi-espèces en biofilm. Le biofilm dentaire est constitué de bactéries, d’une matrice principalement d’origine bactérienne et d’une pellicule acquise exogène sur laquelle viennent adhérer les premières bactéries (bactéries pionnières).
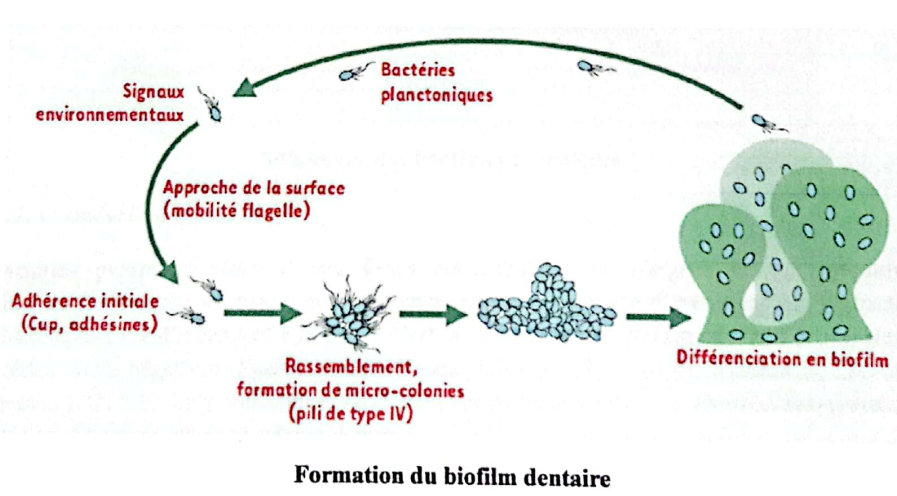
Formation du biofilm dentaire
3.1.1.2.1. La pellicule exogène acquise (PEA)
La pellicule exogène acquise est un élément important car elle constitue l’interface entre la surface de l’émail et la première couche du biofilm oral. La pellicule exogène acquise est un film d’origine salivaire dépourvu d’éléments cellulaires et de bactéries. Elle recouvre rapidement toute surface exposée à l’environnement buccal et on trouve ainsi des protéines détectables à peine 3 minutes après brossage et polissage professionnel. Elle constitue l’interface entre la surface de l’émail et la première couche du biofilm oral.
À noter que la pellicule exogène acquise trouvée dans le sillon gingivo-dentaire est différente car elle comprend en plus des constituants provenant du fluide gingival comme notamment les phospholipides.
4 Rôles :
- Elle sert de lubrifiant qui va donc protéger les surfaces contre l’usure.
- Elle est tenace car ne s’élimine pas avec des simples méthodes d’hygiène habituelles.
- Elle joue un rôle dans l’homéostasie minérale de l’émail dentaire en formant une barrière et un tampon contre les agents de déminéralisation.
- Elle permet la fixation de bactéries.
- Sa structure lui confère la possibilité de retenir certaines bactéries buccales ce qui initie alors la première étape de formation du biofilm.
3.1.1.2.2. Adhérence des bactéries pionnières
Tout d’abord, les bactéries se fixent légèrement à la dent par des forces physiques, puis elles s’ancrent solidement à des récepteurs de la PEA à l’aide de molécules de surface spéciales (adhésines) : ce sont les premières colonisatrices, les bactéries pionnières. Il s’agit en premier lieu des Streptocoques du groupe mitis (S. mitis, S. oralis, S. sanguinis…) ainsi que des Actinomyces (A. naeslundii, A. israelii et A. odontolyticus en particulier).
La liaison entre deux bactéries en suspension est appelée adhérence interbactérienne ou co-agrégation tandis que la co-adhérence est la liaison d’une bactérie libre à une autre déjà fixée.

Adhérence des bactéries pionnières
3.1.1.2.3. Colonisation secondaire
Les bactéries pionnières résistent aux fortes concentrations en oxygène et aux mécanismes d’élimination de la cavité buccale. Leur croissance permet l’adhérence d’autres espèces de bactéries incapables de se fixer directement à la PEA : c’est la colonisation secondaire. Il s’agit principalement de bactéries Gram négatives (Fusobacterium, Haemophilus, Porphyromonas, Veillonella, Prevotella, Treponema…). De plus, les streptocoques fabriquent des polysaccharides extracellulaires qui protègent les bactéries et forment ainsi des microcolonies.
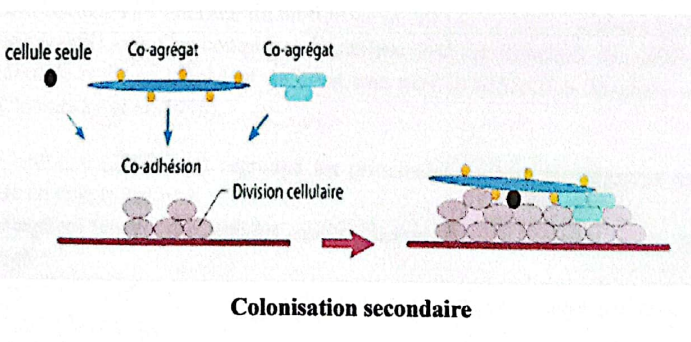
Colonisation secondaire
3.1.1.2.4. Maturation du biofilm
Les microcolonies se regroupent sous forme de complexes ayant les mêmes avantages métaboliques que les bactéries constituantes. Un système circulatoire se forme dans le biofilm. Les microorganismes peuvent échanger des métabolites, des facteurs de résistance et de virulence. Au fur et à mesure que le nombre de couches augmente, de nouvelles conditions environnementales apparaissent, le taux d’oxygène diminue et les bactéries anaérobies se développent. L’équilibre est atteint en 2 à 3 semaines et c’est la rupture de cet équilibre qui est à l’origine de la carie dentaire et des maladies parodontales. À ce stade, le système de défense de l’hôte est activé par les métabolites et les composants de la paroi cellulaire rejetés mais les bactéries sont protégées contre les granulocytes et les biocides.
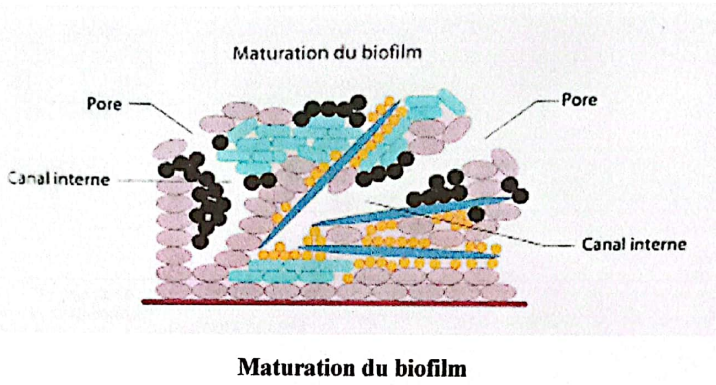
Maturation du biofilm
La dernière étape est la phase de dispersion, appelée aussi phase planctonique. Sous l’effet du vieillissement du biofilm, les cellules microbiennes vont se séparer du biofilm et se disperser pour adhérer à de nouvelles surfaces et former un nouveau biofilm (Tremblay et al., 2014).
3.1.1.3. Les complexes bactériens
Socransky et Haffajee, en 1992, ont énoncé quatre facteurs qui, réunis simultanément, sont nécessaires à l’initiation de la maladie parodontale :
- Environnement local favorable
- Absence de bactéries protectrices
- Présence de bactéries parodontopathogènes
- Hôte défaillant
Les travaux de Socransky et collaborateurs (Socransky et al., 1998) ont permis de démontrer que l’association des bactéries à l’intérieur du biofilm ne se fait pas de façon aléatoire mais plutôt à travers des associations spécifiques. Ces complexes bactériens sont représentatifs des différents stades de la maladie parodontale et ils se succèdent de l’état sain vers la destruction tissulaire observée lors des parodontites (Socransky et al., 1998).
Socransky et Haffajee (2005) ont regroupé les principales espèces bactériennes occupant la niche supra-gingivale en cinq complexes :
- Le complexe jaune comprend les espèces Streptococcus incluant S. oralis, S. sanguinis et S. gordonii.
- Le complexe vert est constitué des espèces A. actinomycetemcomitans, E. corrodens et Capnocytophaga spp.
- Le complexe mauve est composé de Veillonella parvula et Actinomyces odontolyticus. Les membres de ce complexe, associés aux précédents, sont considérés comme les colonisateurs primaires de la dent et leur croissance induit la prolifération des complexes qui les suivront (orange et rouge) (Socransky et Haffajee, 2002).
- Le complexe orange est composé des espèces Fusobacterium sp., Prevotella sp., Campylobacter sp., P. micros et Streptococcus constellatus. Les bactéries de ce groupe secrètent les substances nutritives nécessaires pour l’agrégation de bactéries, la croissance et la maturation du biofilm.
- Le complexe rouge est composé des espèces P. gingivalis, T. denticola et T. forsythia. Ce sont les espèces les plus fortement associées aux signes cliniques de la parodontite.
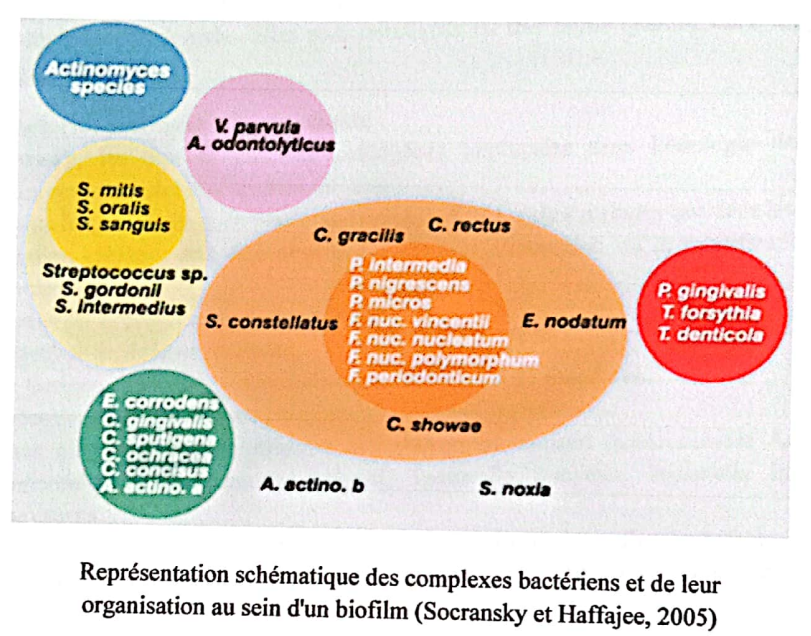
Représentation schématique des complexes bactériens et de leur organisation au sein d’un biofilm (Socransky et Haffajee, 2005)
3.1.1.4. Structure et composition
La nature du biofilm bactérien dentaire est hétérogène. On y trouve notamment :
- Des espèces microbiennes (15 à 20 % en volume) différentes (cocci, bâtonnets, spirochètes, Gram+ et Gram-) organisées en microcolonies.
- Une matrice extracellulaire englobant le biofilm, qui joue le rôle à la fois de barrière physique externe et de lien entre les bactéries (cohésion), se compose de protéines et de polysaccharides et est produite directement par les bactéries du biofilm. Cette matrice est fortement hydratée et favorise la croissance bactérienne par apport de nutriments.
- Des conditions physico-chimiques variées (gradients de pH, teneurs en oxygène).
- Une structure interne inhomogène (vides, canaux aqueux…).
4. Composition de la plaque supra-gingivale
Les premières bactéries à coloniser la surface dentaire sont des bactéries aérobies et anaérobies facultatives à Gram positif, cariogènes telles que les Streptococcus mutans, S. salivarius et S. sanguis. Progressivement, le biofilm des surfaces supra-gingivales s’enrichit de bactéries capables de déclencher une inflammation gingivale.
4. Composition de la plaque sous-gingivale
L’environnement particulier du sillon gingivo-dentaire permet le développement d’une tout autre communauté bactérienne. Cette zone étant dépourvue d’oxygène, le métabolisme des bactéries est de type anaérobie :
- Les échantillons de plaque sous-gingivale de personnes en bonne santé contiennent surtout les espèces Actinomyces (complexe bleu) et, en quantités inférieures, les espèces Streptococcus (complexe jaune) et Veillonella (complexe violet).
- Les bactéries faisant partie du complexe orange (Fusobacterium, Prevotella, Campylobacter rectus) ou du complexe rouge (Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola), sont associées à la maladie parodontale. Elles sont retrouvées en très faible quantité chez les personnes présentant un parodonte sain.
3.1.1.5. Les bactéries pathogènes du parodonte
D’après Socransky, les espèces parodontopathogènes impliquées dans l’étiologie des maladies parodontales doivent répondre aux critères suivants :
- Être isolées plus fréquemment et en plus grand nombre dans les sites malades que dans les sites sains.
- Une amélioration clinique doit être observée après leur élimination ou la modification de leurs facteurs de virulence.
- Être présentes avant la progression de la maladie.
- Stimuler le système de défense de l’hôte.
- Posséder les facteurs de virulence nécessaires à la destruction du parodonte.
Parmi les espèces considérées comme parodontopathogènes, on retrouve :
- Porphyromonas gingivalis
- Aggregatibacter actinomycetemcomitans (anciennement Actinobacillus actinomycetemcomitans)
- Treponema denticola
- Tannerella forsythia
- Prevotella intermedia
- Prevotella nigrescens
D’autres espèces présumées parodontopathogènes incluent :
- Fusobacterium nucleatum
- Peptostreptococcus micros
- Le genre Eubacterium
- Eikenella corrodens
- Campylobacter rectus
3.1.2. Le tartre
3.1.2.1. Définition
C’est la forme calcifiée du biofilm bactérien dentaire qui se dépose au niveau du collet des dents, du sillon gingivo-dentaire et des restaurations dentaires. Il est rare chez l’enfant et très fréquent chez l’adulte.
Il n’est pas pathogène mais sa surface rugueuse constitue un parfait support pour les micro-organismes pathogènes.
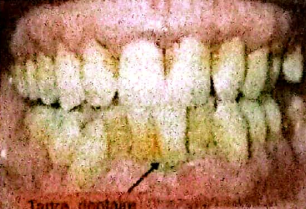
Tartre supra-gingival
3.1.2.2. Classification
On distingue deux sortes de tartre :
- Le tartre sus-gingival ou salivaire :
- Se rencontre plus fréquemment au niveau des faces linguales des incisives inférieures et des faces vestibulaires des molaires supérieures, en regard de l’ostium des glandes salivaires principales.
- Il est souvent blanc ou jaunâtre, à moins que le tabac ou certains pigments n’aient modifié sa couleur.
- Il n’est pas très dur et peut être éliminé par les instruments à détartrage.
- Le tartre sous-gingival ou sérique :
- Il n’est pas visible à l’œil nu, mais peut être observé à la radiographie.
- Il n’a pas de prédilection pour des régions bien déterminées et peut se rencontrer dans n’importe quelle poche parodontale, dont il conditionne approximativement la profondeur.
- Il est brun, noir ou vert foncé, et sa consistance excessivement dure peut dépasser celle du cément et de la dentine.
3.1.2.3. Composition
- Le contenu organique :
- Identique à celui de la plaque (mélange de protéines, polysaccharides, cellules épithéliales desquamées, leucocytes et différents types de micro-organismes).
- Le contenu inorganique :
- Les minéraux présents apparaissent sous différentes formes cristallines.
- Les principaux types sont :
- Hydroxyapatite : 58 %
- Whitelockite : 21 %
- Phosphate octocalcique : 21 %
- Brushite : 9 %
- Particularités du tartre sous-gingival :
- Plus de magnésium et de whitelockite.
- Moins de brushite et de phosphate octocalcique.
- Un rapport phosphocalcique plus élevé.
- Un pourcentage de sodium en rapport avec la profondeur des poches.
3.1.3. La materia alba
- C’est un amas de :
- Micro-organismes,
- Cellules épithéliales desquamées,
- Protéines et lipides salivaires,
- Leucocytes.
- Forme un dépôt mou qu’on peut éliminer par un rinçage de la bouche ou par pulvérisation.
- Couleur : jaunâtre ou gris blanchâtre.
- Visible à l’œil nu.
- Moins adhérente que la plaque dentaire.
3.1.4. Les débris alimentaires
- Bien qu’ils contiennent des micro-organismes, les débris alimentaires sont différents de la plaque et de la materia alba.
- Il s’agit de nourriture molle, à ne pas confondre avec les particules alimentaires retenues dans les espaces inter-proximaux.
- Élimination : dans les minutes qui suivent l’ingestion alimentaire.
- Accumulation dépendante de :
- Flux salivaire,
- Action mécanique de la langue, des joues et des lèvres,
- Forme et alignement des dents.
- Ne constituent pas une cause majeure de l’inflammation parodontale.
- Les colorations noires extrinsèques d’origine bactérienne (« black stains ») :
- Touchent essentiellement les enfants.
- Caractérisées par un liseré noir au collet des dents.
- Retrouvées en denture temporaire, mixte ou définitive.
- Observables à tout âge, mais plus fréquentes et marquées sur les dents temporaires.
- Tendance à diminuer avec l’âge : à la puberté, les changements hormonaux modifient la composition de la salive, entraînant la disparition des bactéries et des colorations.
3.1.5. Facteurs favorisants les dépôts exogènes
Il s’agit de tous les facteurs favorisant l’accumulation bactérienne.
3.1.5.1. Hygiène bucco-dentaire inadéquate
- Absence ou insuffisance de brossage dentaire (mauvaise technique, matériel inapproprié comme une brosse à dents usée).
- Résultat : accumulation de débris alimentaires et bactériens.
3.1.5.2. Facteurs dentaires
- Morphologiques :
- Au niveau coronaire : bombés excessifs, dysplasies de l’émail, sillons corono-radiculaires, défauts de jonction amélo-cémentaire.
- Au niveau radiculaire : cavités proximales, furcations proches de la zone cervicale.
- Malpositions dentaires :
- Versions, rotations : créent des zones protégées du nettoyage spontané et compliquent le contrôle de la plaque par le patient.
- Hypo-fonction liée à l’absence d’antagoniste : augmentation des dépôts exogènes.
- Absence de point de contact : accumulation bactérienne si l’espace inter-dentaire est étroit ; auto-nettoyage si l’espace est très large.
- Pathologie corono-radiculaire :
- Cavités de caries, fêlures, fractures.
3.1.5.3. Facteurs muqueux et musculaires
- Insertion pathologique des freins et des brides.
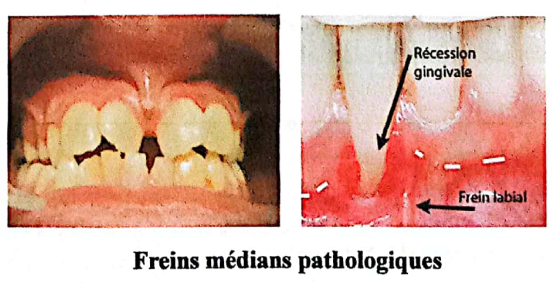
- Exemple : insertion du frein labial volumineux au niveau de la gencive marginale (freins médians pathologiques).
3.1.5.4. Facteurs iatrogènes
- Obturation débordante, insuffisance de la qualité/finition des obturations et prothèses, traitement orthodontique inadéquat : favorisent la rétention et l’accumulation du biofilm bactérien.
- Effets sur le parodonte :
- Favorisent l’adhésion bactérienne.
- Peuvent représenter une agression physique.
- Rôle de la gencive : assurer un joint étanche pour l’os sous-jacent via l’espace biologique (épithélium jonctionnel + attache conjonctive).
- Problème : aucun matériau d’obturation n’est biocompatible pour permettre une adhésion tissulaire.
- Conséquence d’une violation de l’espace biologique : rupture du système d’attache, inflammation gingivale chronique.
3.2. Facteurs indirects
- Représentés par les surcharges parodontales : forces dépassant la capacité d’adaptation du parodonte, entraînant des modifications du desmodonte et de l’os alvéolaire.
- Causes :
- Habitudes vicieuses : mordillement de crayon, d’épingles ou de pipe.
- Pulsion linguale : déglutition atypique (infantile) ou macroglossie.
- Causes iatrogènes :
- Prothèses fixes en sur-occlusion ou en extension déséquilibrée.
- Prothèses amovibles mal adaptées (crochets, plaque base traumatisante).
- Appareillages orthodontiques inadéquats.
- Égressions dentaires : liées au non-remplacement des dents antagonistes.
- Bruxisme : état para-fonctionnel de fermeture répétée des mâchoires, avec crispations et déplacements (diduction, propulsion, rétropulsion).
4. Facteurs généraux
Question : une maladie générale peut-elle seule entraîner une maladie parodontale ?
Deux situations distinctes :
- La maladie parodontale est un symptôme d’un syndrome général (ex. : kératodermie palmoplantaire, hypophosphatasie, histiocytoses X, acatalasie, ostéopathies métaboliques, syndrome de Down, irradiations, sclérodermie, intoxications, neutropénie cyclique).
- La maladie parodontale est causée par une maladie générale : pas de lien direct de cause à effet, mais des influences possibles mises en évidence par expérimentations (animal/humain) sur certaines pathologies systémiques et déséquilibres métaboliques.
4.1. Phénomènes physiologiques
- a. Vieillissement :
- Double rôle : augmentation de la durée d’exposition aux facteurs déclenchants + modifications biologiques (immunité, physiologie des tissus).
- b. Phénomènes hormonaux :
- Modifications hormonales (puberté, cycle ovarien, grossesse, ménopause) : grande fréquence de maladies gingivales, aggravation des parodontolyses préexistantes.
4.2. Habitus
- Facteurs culturels, ethniques, socio-économiques, habitudes nutritionnelles : rôle via leur influence sur l’éducation et l’élimination du biofilm bactérien.
4.3. Troubles nutritionnels
- Carences vitaminiques (A1, B1, C, D) : rôle modifiant, aggravant l’action des facteurs déclenchants.
4.4. Intoxications
- Bismuth, plomb, mercure, phosphore, arsenic, chrome, benzène (traitements médicaux ou contacts professionnels) :
- Modifications gingivales localisées dans les zones d’inflammation préexistantes.
- Ulcérations avec destruction de l’os alvéolaire.
4.5. Pathologies digestives
- Glandes salivaires :
- Modifications quali/quantitatives de la salive (atteinte glandulaire, syndrome, thérapeutiques chimiques/physiques comme irradiations) : répercussions sur la flore buccale, qui devient plus pathogène.
- Pathologies digestives :
- Cirrhose éthylique : rôle étiologique admis.
- Autres pathologies hépatiques : rôle modifiant selon gravité.
4.6. Déficits immunitaires
4.6.1. Congénitaux
- Tous les grands syndromes avec dysfonctions phagocytaires : parodontite sévère à début précoce (deux dentures).
- Exemples :
- Syndrome de Down (trisomie 21) : réponse inflammatoire exagérée, rapport T4/T8 élevé.
- Syndrome de Papillon-Lefèvre : dysplasie ectodermique rare, kératodermie palmoplantaire + parodontite précoce, défaut du chimiotactisme des granulocytes neutrophiles.
- Syndrome de Chediak-Higashi : albinisme oculo-cutané, cheveux argentés, hypertrophie hépato-spléno-ganglionnaire, infections récurrentes, parodontite sévère précoce, souvent mortelle avant 7 ans sans greffe de cellules souches.
- Neutropénie cyclique : répétition tous les 21 jours d’infections fébriles (muqueuses, otites, respiratoires, abcès), gingivite à parodontite évolutive (dentures mixtes/définitive).
4.6.2. Acquis
- Infection par le VIH (SIDA) :
- Affaiblissement immunitaire (VIH).
- Manifestations : gingivorragies, gingivites/gingivostomatites persistantes/récidivantes, aphtes récidivants.
4.6.3. Dus à des médicaments
- Médicaments immunosuppresseurs (corticoïdes, antimétabolites comme azathioprine, traitements des leucémies) : parodontites graves, abcès parodontaux (flore opportuniste).
4.7. Affections hématologiques
- Anémies :
- Pâleur gingivale.
- Anémies hypochromes : corrélation avec parodontolyse variable.
- Drépanocytose : ostéoporose des maxillaires (80 %).
- Agranulocytose :
- Diminution des polynucléaires (iatrogène ou idiopathique) : ulcérations buccales, parodontolyse mutilante.
- Polyglobulies :
- Augmentation anormale d’hémoglobine/globules rouges : modifications de couleur des muqueuses.
- Leucémies :
- Réaction inflammatoire variable selon facteurs locaux, moindre résistance au biofilm (dégénérescence gingivale, anoxie tissulaire), lésions ulcéro-nécrotiques fréquentes (formes aiguës/subaiguës).
4.8. Pathologies dermatologiques
- Sclérodermie : parodontolyse localisée (sclérose atrophique, sans lien avec dépôts exogènes).
- Maladie de Papillon-Lefèvre : kératodermie palmoplantaire héréditaire + parodontolyse aiguë généralisée (deux dentitions).
- Syndrome de Job : infections staphylococciques, lésions eczématiformes, IgE élevées, parodontolyse évolutive (dépôts exogènes + déficit immunitaire).
4.9. Pathologies endocriniennes
- Diabète :
- Ne déclenche pas gingivite/parodontite, mais altère la réaction aux facteurs déclenchants, accélère l’inflammation.
- Manifestations : xérostomie, hyperesthésie gingivale/desmodontale, gingivite disproportionnée, parodontite évolutive (plus marquée après 10 ans).
- Hypothyroïdisme, hyperparathyroïdisme : favorisent parodontolyses.
4.10. Chimiothérapie
- Aucun médicament ne provoque directement de parodontolyses, mais certains (ex. diphényl-hydantoïnate sodique) entraînent un accroissement gingival favorisant la rétention du biofilm.
- Pilule anticonceptionnelle : action suspectée via modifications hormonales.
5.11. Autres facteurs
- Stress :
- Action systémique (altération immunitaire) ou locale (parafonctions comme bruxisme).
- Caractère chronique, lié à l’incapacité à le surmonter.
- Tabac :
- Facteur de risque majeur.
- Effets : altération des défenses bactériennes, réduction de la vascularisation gingivale, masquage des symptômes inflammatoires, moindre réponse aux traitements.
- Rôle du praticien : informer le patient des conséquences et du bénéfice de l’arrêt.
Conclusion
- Les maladies parodontales sont multifactorielles, déclenchées par le biofilm bactérien.
- L’accumulation des dépôts exogènes dépend de facteurs de rétention/favorisants.
- La réaction des tissus parodontaux est modifiée par des facteurs généraux (physiologiques/pathologiques).
- Solution : découverte du lien biologique entre agents agresseurs (bactérien, biochimique, chimique, physique) et parodonte pour améliorer prévention et traitement.
Bibliographie
- Boutigny H, Delcourt-Debruyne. Etiologie des parodontites.
- Chardin, H., Barsotti, O. & Bonnaure-Mallet, M. Microbiologie en odontostomatologie. (Maloine, 2006).
- Chapple Iain L C, Gilbert Angela D. Understanding Periodontal Diseases Assessment and Diagnostic Procedures in Practice. Quintessentials of Dental Practice-1. Periodontology-1.
- Charon, J. A. Parodontie médicale innovations cliniques. (Éd. CdP, 2009).
- Ciancio S. Biofilm dynamics at the gingival frontier. Int Dent J. 2010;60:200-203.
- Wolf, H. F., Rateitschak, K. H. & Rateitschak, E. M. Parodontologie. (Masson, 2005).
- Lindhe J. Manuel de parodontologie clinique. Editions Cdp 1986.
- Rateitschak KH., E M et Wolf H.F. Atlas de Médecine Dentaire. Parodontologie. 1985.
- Tremblay Yannick D.N, Hathroubi S et al. Les biofilms bactériens: leur importance en santé animale et en santé publique. The Canadian Journal of Veterinary Research : 78:110-116. 2014.
ÉTIOLOGIE DES MALADIES PARODONTALES
Voici une sélection de livres:
Parodontologie Relié – 1 novembre 2005
Guide pratique de chirurgie parodontale Broché – 19 octobre 2011
Parodontologie Broché – 19 septembre 1996
MEDECINE ORALE ET CHIRURGIE ORALE PARODONTOLOGIE
Parodontologie: Le contrôle du facteur bactérien par le practicien et par le patient
Parodontologie clinique: Dentisterie implantaire, traitements et santé
Parodontologie & Dentisterie implantaire : Volume 1
Endodontie, prothese et parodontologie
La parodontologie tout simplement Broché – Grand livre, 1 juillet 2020


Leave a Reply