COLLAGÈNE : STRUCTURE-SYNTHÈSE-DÉGRADATION
INTRODUCTION
Le collagène est un constituant essentiel du tissu conjonctif, il entre dans la composition de tous les tissus dentaires sauf l’émail, et il joue un rôle important dans le développement, la structure et la physiologie de la dent et de ses tissus de soutien. Cette macromolécule protéinique est la plus abondante du règne animal (30 à 35% des protéines totales de l’organisme humain). Elle est secrétée par les fibroblastes.
1. DÉFINITION
Le terme collagène signifie “producteur de colle”. Ainsi, on pourrait définir le mot “collagène” comme étant une “colle” qui retient et forme l’ensemble de tous les tissus conjonctifs du corps (os, cartilages, muscles, tendons, ligaments, peau…).
2. STRUCTURE
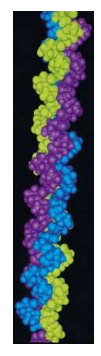
Le tropocollagène représente l’unité moléculaire fondamentale du collagène fibreux insoluble :
- Poids moléculaire de 300 000.
- Longueur de 2800 à 3000 Å.
- Largeur de 14 Å.
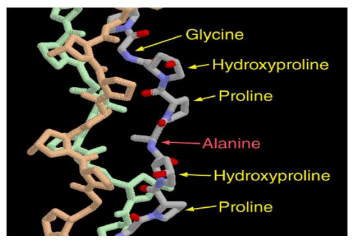
Il est constitué de 03 chaînes polypeptidiques (chaînes α) enroulées en triple hélice ayant chacune un poids moléculaire de 96 000.


3. TYPAGE DU COLLAGÈNE
En fonction de la répartition des acides aminés, on distingue 5 types de chaînes α :
- 4 chaînes dites α1.
- 1 chaîne dite α2.
Exemple : collagène type I est constitué de deux chaînes α1 type 1 et une chaîne α2.
En fonction de la répartition de ces 5 chaînes α au sein de la molécule, on décrit plusieurs types de collagène :
| TYPE | DESCRIPTION | LOCALISATION |
|---|---|---|
| I | 2 chaînes α1 type I, 1 chaîne α2 | Peau, os, tendons, dentine, gencive, pulpe |
| II | 3 chaînes α1 type II | Cartilage |
| III | 3 chaînes α1 type III | Vaisseaux sanguins, peau, gencive, pulpe |
| IV | 3 chaînes α1 type IV | Membranes basales |
| V | αA, αB | Placenta, muscles lisses |
4. RÔLES DU COLLAGÈNE
- Le collagène sert de matériau à la construction de divers tissus conjonctifs.
- Le collagène est une protéine fibreuse. Les tissus qui contiennent du collagène sont plus résistants et ont plus d’élasticité comparativement à ceux qui n’en possèdent pas.
- Le rôle biologique du collagène est double. D’une part, avec l’élastine, les protéoglycanes et les glycoprotéines, il fait partie de la matrice extracellulaire responsable de la cohésion des tissus et des organes. D’autre part, le collagène confère la résistance, la souplesse et l’élasticité aux différents tissus. Les altérations du collagène se répercutent sur le fonctionnement de nombreux tissus et organes.
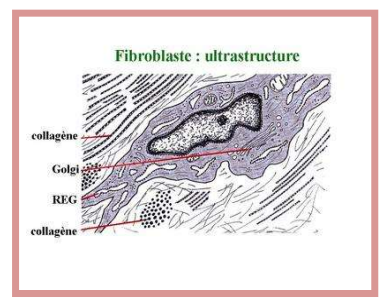
5. BIOSYNTHÈSE DU COLLAGÈNE
La biosynthèse du collagène se fait par les fibroblastes (cellules responsables aussi de sa dégradation). Le collagène au cours de sa biosynthèse (à l’intérieur de la cellule) est appelé : protropocollagène. Les étapes de biosynthèse se succèdent comme suit :
5.1. Au niveau du réticulum endoplasmique granuleux
- Synthèse des acides aminés et leur assemblage en chaînes polypeptidiques pro-alpha.
- Hydroxylation par branchement d’un groupe hydroxyle (OH) sur les acides aminés (lysine en hydroxylysine – proline en hydroxyproline) sous l’action de deux enzymes (lysine hydroxylase – proline hydroxylase). Cette réaction d’hydroxylation est dépendante de l’oxygène et de la vitamine C.
- Liaison des chaînes pro-alpha par groupe de trois par des ponts disulfures.
- Enroulement de la molécule de protropocollagène en triple hélice.


5.2. Au niveau de l’appareil de Golgi
Une fois organisée, la triple hélice quitte le réticulum endoplasmique granuleux vers l’appareil de Golgi où elle subira une glycosylation par branchement d’unités monosaccharidiques (galactose) ou disaccharidiques (glucose + galactose) et ceci par l’action d’une enzyme : glycosyl transférase.
5.3. Au niveau des vésicules d’exocytose
L’appareil de Golgi se fragmente à ses extrémités pour former des structures membranaires (vésicules d’exocytose) renfermant la molécule de protropocollagène. Ces vésicules vont se rapprocher de la membrane cytoplasmique pour déverser leur contenu dans le milieu extracellulaire.
6. MATURATION DU COLLAGÈNE
La maturation du collagène s’effectue dans le milieu extracellulaire et consiste en une transformation de la molécule de tropocollagène (collagène natif) en un collagène mature et insoluble. Cette maturation est le résultat de l’augmentation des liaisons intramoléculaires et intermoléculaires ainsi que des liaisons avec la substance fondamentale.
6.1. Augmentation des liaisons intramoléculaires et intermoléculaires (cross-links)

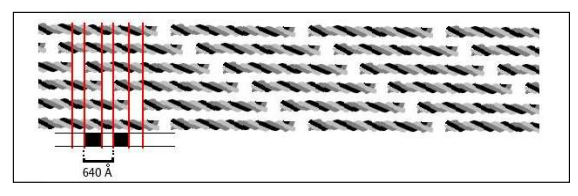
C’est l’attachement des molécules de tropocollagène entre elles par des liaisons intermoléculaires (cross-links) de type réaction de Schiff. Formation de la fibrille (200 à 2000 Å de diamètre).

En microscopie électronique, les fibrilles de collagène présentent des striations transversales d’une périodicité caractéristique de 640 Å, reflétant l’arrangement des molécules de collagène individuelles dans la fibrille. Chaque molécule étant décalée de la molécule adjacente d’un 1/4 de sa longueur.
6.2. Interaction entre les fibrilles de collagène et les molécules de la substance fondamentale
Ces éléments sont les glycosaminoglycanes et les protéoglycanes. Les glycosaminoglycanes sont des polymères d’unités disaccharidiques composées d’un acide uronique et une hexosamine (acide hyaluronique, acide chondroïtine sulfate). Leur liaison avec des protéines au sein de la substance fondamentale contribue à la formation de protéoglycanes. Les protéoglycanes s’attachent aux fibrilles et aux fibres de collagène par le biais de leurs chaînes saccharidiques, ceci aurait pour conséquence une augmentation de la réticulation et de l’insolubilité du collagène. Ces protéoglycanes simples peuvent être reliées entre elles par une molécule de glycosaminoglycane de type acide hyaluronique.
7. TURN OVER DU COLLAGÈNE
C’est le renouvellement permanent d’une partie du collagène. Il consiste en une dégradation suivie d’une synthèse de nouvelles molécules de collagène. Sa rapidité varie d’un tissu à un autre (collagène du LAD est cinq fois plus rapide que celui de la gencive et de l’os alvéolaire et 15 fois plus rapide que celui de la peau). Ce phénomène diminue progressivement avec l’âge.
8. DÉGRADATION DU COLLAGÈNE
8.1. Dégradation physiologique
Le collagène est détruit physiologiquement par 02 principaux mécanismes :
- Mécanisme phagocytaire.
- Mécanisme enzymatique.
8.1.1. Mécanisme phagocytaire
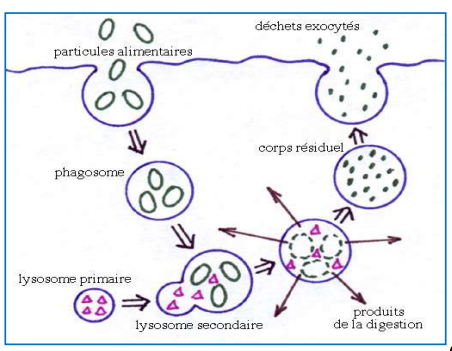
La phagocytose est un mécanisme qui permet à une cellule d’absorber un élément extracellulaire solide et de le digérer. La phagocytose fait intervenir deux éléments :
- La membrane cytoplasmique qui formera les phagosomes à l’intérieur desquels se trouve le corps à phagocyter.
- Les lysosomes qui sont des structures membranaires remplies d’enzymes hydrolytiques.
Le fibroblaste est la cellule responsable de la synthèse du collagène et de sa dégradation. Lorsqu’un fibroblaste s’apprête à phagocyter, il apparaît de la collagénase sur sa surface membranaire. Cette dernière va fragmenter la molécule de collagène la rendant attaquable par les enzymes hydrolytiques des lysosomes.
8.1.2. Mécanisme enzymatique
Dans les conditions physiologiques normales, le collagène peut être détruit par une enzyme tissulaire : la collagénase tissulaire. Elle est retrouvée dans le milieu extracellulaire sous une forme inactive : procollagénase et sous l’influence d’activateurs, elle se transforme en : collagénase tissulaire vraie que les inhibiteurs puissent l’inactiver à nouveau.
La collagénase tissulaire a un poids moléculaire variant de 25 000 à 100 000. À un pH neutre et à une température de 37°C, elle coupe la molécule de collagène natif en deux fragments d’inégale longueur :
- 3/4 de la longueur contient le NH₂ terminal.
- 1/4 de la longueur renferme le COOH terminal.
Ces deux fragments seront métabolisés secondairement par les enzymes protéolytiques en peptides puis en acides aminés.
8.1.3. Facteurs de la régulation
La régulation de l’activité collagénolytique dépend :
- Du type même du collagène : type II plus résistant que le type I.
- De l’âge : augmentation des cross-links intra et intermoléculaires.
- Des variations du pH et de la température.
- De certaines protéines et hormones.
8.2. Dégradation pathologique du collagène
La destruction pathologique du collagène se fait :
- Soit par amplification des mécanismes enzymatiques.
- Soit par accentuation du mécanisme phagocytaire.
8.2.1. Augmentation de la destruction sur le mode enzymatique
L’augmentation de l’activité collagénolytique se réalise :
- Spontanément par augmentation de la sécrétion des collagénases tissulaires.
- Par arrivée d’éléments extérieurs porteurs d’une collagénase (leucocytes polynucléaires, macrophages, bactéries).
Augmentation spontanée de l’activité collagénasique tissulaire
Elle est en relation avec :
- Soit d’une diminution quantitative des inhibiteurs.
- Soit d’une augmentation des activateurs.
La sécrétion de la collagénase tissulaire est intense en période inflammatoire.
Augmentation de l’activité collagénasique par arrivée d’éléments extérieurs
Certaines bactéries peuvent être impliquées dans la destruction du collagène : Bacteroide melaninogenicus qui peut agir par sa propre collagénase ou indirectement par ses endotoxines qui activent la transformation de la collagénase osseuse en collagénase vraie. Les bactéries de la plaque dentaire du sillon gingival peuvent activer la réaction pro-enzyme → enzyme. La plupart des bactéries impliquées dans la maladie parodontale sécrètent des enzymes protéolytiques qui dégradent les peptides résultant du fractionnement des chaînes α. Les leucocytes polynucléaires, dont le nombre se trouve considérablement augmenté au cours d’une inflammation, sécrètent une collagénase tissulaire qui hydrolyse le collagène natif (Lazarus et al. 1968). Les macrophages contribueraient eux aussi au cours de la maladie parodontale à la destruction du collagène des tissus parodontaux par le biais de leur collagénase tissulaire.
8.2.2. Augmentation de l’activité phagocytaire
Cette augmentation de la destruction est assurée d’une part par les macrophages (phagocytose + activité collagénolytique) et d’autre part par les fibroblastes qui n’augmentent pas en nombre au cours de la maladie parodontale mais phagocytent le collagène en plus grande quantité.
CONCLUSION
Le collagène est un constituant essentiel des tissus conjonctifs. Il entre dans la composition de tous les tissus du parodonte et joue un rôle prépondérant dans la réparation et la régénération parodontales. Son altération affectera l’état de santé du parodonte.
COLLAGÈNE : STRUCTURE-SYNTHÈSE-DÉGRADATION
La prévention des caries repose sur une hygiène bucco-dentaire rigoureuse et des visites régulières chez le dentiste. La maîtrise des techniques d’anesthésie locale est essentielle pour assurer le confort du patient lors des soins. L’imagerie dentaire, comme la radiographie panoramique, permet un diagnostic précis des pathologies buccales. Les étudiants doivent comprendre l’importance de la stérilisation pour prévenir les infections croisées en cabinet. La restauration dentaire, comme les composites ou les couronnes, exige une précision technique et un sens esthétique. Les praticiens doivent rester informés des avancées en implantologie pour proposer des solutions modernes aux patients. Une communication claire avec le patient renforce sa confiance et favorise l’adhésion au plan de traitement.
COLLAGÈNE : STRUCTURE-SYNTHÈSE-DÉGRADATION

Dr J Dupont, chirurgien-dentiste spécialisé en implantologie, titulaire d’un DU de l’Université de Paris, offre des soins implantaires personnalisés avec expertise et technologies modernes.