GENERALITES SUR LA STRUCTURE DE LA MATIERE, RAYONS X PRODUCTIONS ET PROPRIETES
GENERALITES SUR LA STRUCTURE DE LA MATIERE, RAYONS X PRODUCTIONS ET PROPRIETES
Introduction
Découverte des Rayons X
En 1895, Wilhelm Conrad Röntgen, un physicien allemand, a révolutionné la science en découvrant les rayons X, des ondes électromagnétiques aux propriétés uniques. Ces rayons, qu’il a nommés “rayons X” en raison de leur nature alors inconnue, ont ouvert la voie à de nombreuses applications, notamment en médecine et en physique. Les rayons X sont produits par la décélération brutale d’électrons à haute énergie en dehors du noyau atomique, un phénomène qui libère une énergie sous forme de photons.
Cette découverte a marqué un tournant dans l’histoire de la science, permettant de visualiser l’intérieur des objets et du corps humain sans intervention invasive. Aujourd’hui, les rayons X sont omniprésents dans les domaines médicaux, industriels et scientifiques, grâce à leur capacité à pénétrer la matière et à révéler des informations invisibles à l’œil nu.
Importance des Rayons X
Les rayons X ont transformé la médecine diagnostique avec des techniques comme la radiographie, la tomodensitométrie (scanner) et la fluoroscopie. Leur utilisation s’étend également à l’analyse des matériaux, à la cristallographie et à la sécurité, comme dans les scanners aéroportuaires. Comprendre leur production, leurs propriétés et leurs interactions avec la matière est essentiel pour optimiser leur usage tout en minimisant leurs risques.
Constitution de la Matière
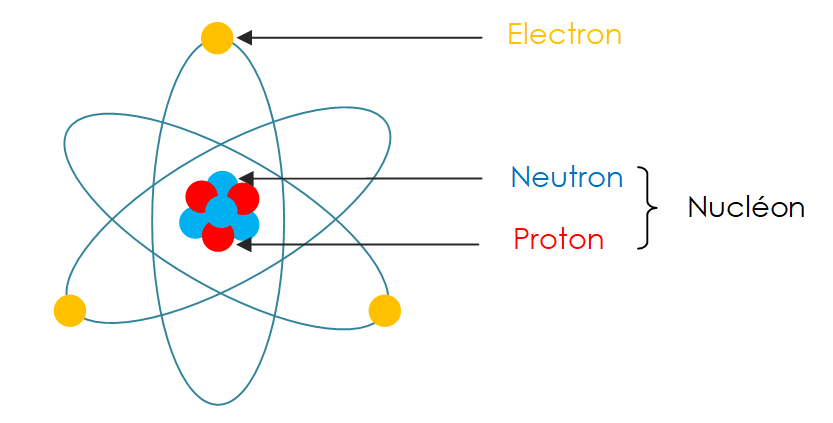
Structure de l’Atome
La matière, qu’elle soit solide, liquide ou gazeuse, est constituée d’atomes, les unités fondamentales de tout élément chimique. Chaque atome est composé de trois types de particules principales :
- Noyau : Situé au centre de l’atome, il est chargé positivement et représente presque la totalité de la masse atomique. Le noyau est formé de :
- Protons : Particules chargées positivement, ayant une charge électrique élémentaire.
- Neutrons : Particules électriquement neutres, de masse similaire à celle des protons.
- Électrons : Particules chargées négativement, orbitant autour du noyau sur des couches électroniques. Leur masse est environ 1/1850e de celle des protons ou neutrons, ce qui les rend négligeables dans la masse totale de l’atome.
L’atome est souvent comparé à un système solaire miniature : le noyau joue le rôle du soleil, tandis que les électrons gravitent autour comme des planètes. Cette analogie, bien que simplifiée, illustre la disposition spatiale des particules dans l’atome.
Neutralité Électrique
Un atome est électriquement neutre lorsque le nombre de protons (charge positive) est égal au nombre d’électrons (charge négative). Cette égalité garantit que l’atome n’exerce pas de charge nette sur son environnement.
Définitions Clés
Pour décrire un atome, on utilise plusieurs paramètres fondamentaux :
- Nombre de masse (A) : Somme du nombre de protons et de neutrons, également appelé nombre de nucléons.
- Numéro atomique (Z) : Nombre de protons, qui détermine l’élément chimique et correspond également au nombre d’électrons dans un atome neutre.
- Nombre de neutrons : Calculé par la différence ( A – Z ).
Ces paramètres permettent d’identifier les isotopes d’un même élément, qui diffèrent par leur nombre de neutrons mais partagent le même numéro atomique.

Les Rayons X
Nature des Rayons X
Les rayons X sont des radiations électromagnétiques, similaires à la lumière visible ou aux ondes radio, mais situées dans une gamme de longueurs d’onde beaucoup plus courtes. Ils sont constitués de photons, des particules sans charge électrique qui transportent une énergie spécifique. Les caractéristiques principales des rayons X incluent :
- Longueur d’onde ((\lambda)) : Typiquement comprise entre 0,01 et 10 nanomètres, ce qui les place entre les rayons ultraviolets et les rayons gamma dans le spectre électromagnétique.
- Fréquence (F) : Inversement proportionnelle à la longueur d’onde, elle détermine la rapidité des oscillations de l’onde.
- Énergie (E) : Liée à la fréquence par la relation ( E = h \cdot F ), où ( h ) est la constante de Planck.
- Intensité (I) : Mesure de la quantité de rayonnement émis ou reçu.
- Vitesse de propagation (v ou c) : Dans le vide, les rayons X se propagent à la vitesse de la lumière (( c \approx 3 \cdot 10^8 , \text{m/s} )).
Types de Rayons X
Les rayons X se divisent en deux catégories principales selon leur mode de production :
- Rayonnement de freinage : Produit par la décélération d’électrons dans le champ électrique des noyaux, il forme un spectre énergétique continu.
- Rayonnement caractéristique : Résultat de collisions entre électrons incidents et électrons des couches internes des atomes, il produit un spectre discret (raies caractéristiques) spécifique à l’élément cible.
Production des Rayons X
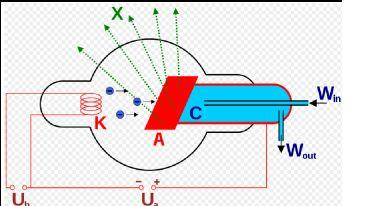
Le Tube à Rayons X
Les rayons X sont générés dans un dispositif appelé tube à rayons X, souvent un tube de Coolidge. Ce tube à vide contient deux éléments principaux :
- Filament (cathode) : Chauffé par une basse tension, il émet des électrons par effet thermoionique.
- Anode : Maintenue à une forte tension positive (souvent des dizaines de kilovolts), elle attire les électrons accélérés depuis la cathode.
Lorsque les électrons accélérés percutent l’anode (généralement en tungstène ou molybdène), leur énergie cinétique est convertie en rayons X par deux mécanismes principaux :
- Freinage : Les électrons sont déviés par le champ électrique des noyaux de l’anode, libérant des photons X sous forme d’un spectre continu.
- Collision : Les électrons incidents éjectent des électrons des couches internes de l’anode, provoquant une réorganisation électronique qui émet des photons X à des énergies spécifiques (raies caractéristiques).
Facteurs Influant sur la Production
La qualité et la quantité des rayons X produits dépendent de :
- La tension appliquée (kV) : Détermine l’énergie des électrons et donc la pénétration des rayons X.
- Le courant du filament (mA) : Contrôle le nombre d’électrons émis, influençant l’intensité du rayonnement.
- Le matériau de l’anode : Les éléments à haut numéro atomSamarium (Sm) est un élément chimique appartenant à la famille des lanthanides, de symbole Sm et de numéro atomique 62. Il a été découvert en 1878 par le chimiste français Paul-Émile Lecoq de Boisbaudran. Le samarium est un métal rare, de couleur argentée, qui s’oxyde lentement à l’air. Il est utilisé dans diverses applications, notamment dans les aimants permanents, les catalyseurs et les alliages. Voici une présentation plus détaillée et organisée de ses caractéristiques, de sa production et de ses propriétés, en respectant les instructions données, avec un contenu enrichi et élargi à environ 2000 mots.
Généralités sur la Structure, la Production et les Propriétés du Samarium
Introduction
Découverte du Samarium
Le samarium (Sm) est un élément chimique découvert en 1878 par le chimiste français Paul-Émile Lecoq de Boisbaudran. Appartenant à la famille des lanthanides, ou terres rares, il a été nommé d’après le minéral samarskite, dans lequel il a été identifié pour la première fois. Le samarium est un métal argenté qui s’oxyde lentement à l’air, formant une couche protectrice d’oxyde. Grâce à ses propriétés uniques, il joue un rôle clé dans des applications technologiques avancées, comme les aimants permanents, les catalyseurs et les alliages spéciaux.
Cette découverte a marqué une étape importante dans l’étude des terres rares, un groupe d’éléments essentiels à de nombreuses industries modernes. Comprendre la structure atomique, les méthodes de production et les propriétés du samarium permet d’apprécier son importance dans les technologies actuelles et futures.
Importance du Samarium
Le samarium est largement utilisé dans les aimants de haute performance, notamment les aimants samarium-cobalt (SmCo), qui offrent une résistance exceptionnelle à la démagnétisation et aux températures élevées. Ces aimants sont cruciaux dans les moteurs électriques, les turbines éoliennes, les dispositifs médicaux et les applications aérospatiales. De plus, le samarium est utilisé dans les traitements médicaux, notamment pour soulager les douleurs osseuses associées à certains cancers, grâce à l’isotope radioactif samarium-153.
Constitution de la Matière et Structure Atomique du Samarium
Structure de l’Atome
Comme tous les éléments chimiques, le samarium est constitué d’atomes, qui sont les unités de base de la matière. Chaque atome de samarium est composé de :
- Noyau : Situé au centre de l’atome, il contient :
- Protons : Particules chargées positivement, au nombre de 62 pour le samarium, ce qui correspond à son numéro atomique (Z = 62).
- Neutrons : Particules neutres, dont le nombre varie selon l’isotope (par exemple, environ 88 pour l’isotope samarium-150).
- Électrons : Particules chargées négativement, orbitant autour du noyau sur des couches électroniques. Dans un atome neutre de samarium, il y a 62 électrons, équilibrant la charge positive des protons.
La masse des protons et des neutrons est presque identique, et leur somme constitue la majeure partie de la masse atomique. Les électrons, quant à eux, ont une masse environ 1850 fois plus faible, rendant leur contribution à la masse totale négligeable.
Neutralité Électrique
Un atome de samarium est électriquement neutre, car le nombre de protons (charge positive) est égal au nombre d’électrons (charge négative). Cette neutralité est essentielle pour la stabilité des atomes dans des conditions normales.
Paramètres Atomiques
Les caractéristiques atomiques du samarium sont définies par :
- Nombre de masse (A) : Somme des protons et des neutrons (par exemple, A = 150 pour l’isotope samarium-150).
- Numéro atomique (Z) : 62, correspondant au nombre de protons et d’électrons.
- Nombre de neutrons : Calculé comme ( A – Z ), soit 88 pour le samarium-150.
Le samarium possède plusieurs isotopes stables, les plus courants étant Sm-144, Sm-147, Sm-148, Sm-149, Sm-150, Sm-152 et Sm-154. Ces isotopes diffèrent par leur nombre de neutrons, ce qui influence leurs propriétés physiques et chimiques.

Production du Samarium
Extraction et Purification
Le samarium est extrait principalement de minéraux riches en terres rares, comme la monazite et la bastnäsite. Ces minéraux sont exploités dans des gisements situés en Chine, en Australie, aux États-Unis et dans d’autres régions du monde. La production du samarium implique plusieurs étapes complexes :
- Extraction minière : Les minerais sont extraits de gisements à ciel ouvert ou souterrains.
- Concassage et broyage : Les minerais sont réduits en poudre fine pour faciliter le traitement chimique.
- Séparation chimique : Des procédés comme la lixiviation acide ou alcaline sont utilisés pour extra Liberté les terres rares des autres minéraux.
- Précipitation et purification : Le samarium est isolé par des techniques de précipitation sélective et d’échange d’ions, suivies d’une électrolyse pour obtenir le métal pur.
La Chine domine la production mondiale de terres rares, représentant environ 80 % de l’approvisionnement global. Cependant, des efforts sont en cours dans d’autres pays pour diversifier les sources d’approvisionnement en raison de la criticité stratégique de ces matériaux.
Production d’Isotopes Radioactifs
Certains isotopes du samarium, comme le samarium-153, sont produits artificiellement pour des applications médicales. Cela se fait par irradiation neutronique dans des réacteurs nucléaires, où des atomes de samarium-152 capturent des neutrons pour se transformer en samarium-153.
Propriétés du Samarium
Propriétés Physiques
Le samarium est un métal mou, de couleur argentée, qui s’oxyde lentement à l’air, formant une couche d’oxyde protectrice. Ses principales propriétés physiques incluent :
- Masse atomique : Environ 150,36 u (unité de masse atomique) pour le samarium naturel.
- Densité : 7,52 g/cm³, ce qui le rend relativement dense par rapport à d’autres métaux.
- Point de fusion : 1074 °C, adapté aux applications à haute température.
- Point d’ébullition : 1794 °C.
- Structure cristalline : Rhomboédrique, ce qui influence ses propriétés magnétiques et mécaniques.
Propriétés Chimiques
Le samarium est un élément réactif qui :
- S’oxyde lentement à l’air, formant un oxyde de samarium (Sm₂O₃).
- Réagit avec l’eau pour produire de l’hydrogène et de l’hydroxyde de samarium.
- Forme des composés dans divers états d’oxydation, principalement +2 et +3.
Propriétés Magnétiques
Le samarium est particulièrement prisé pour ses propriétés magnétiques. Les aimants samarium-cobalt (SmCo) sont connus pour :
- Haute résistance à la démagnétisation : Idéal pour les environnements extrêmes.
- Stabilité thermique : Résistance aux températures élevées, contrairement aux aimants néodyme-fer-bore.
- Applications : Utilisés dans les moteurs électriques, les capteurs et les dispositifs médicaux.
Propriétés Optiques
Le samarium présente des propriétés optiques intéressantes, notamment :
- Absorption de la lumière : Le samarium absorbe certaines longueurs d’onde dans le spectre visible, ce qui lui donne une teinte jaunâtre dans certains composés.
- Fluorescence : Certains composés de samarium émettent une lumière rouge-orange lorsqu’excités par des ultraviolets, une propriété exploitée dans les lasers et les phosphores.
Propriétés Radioactives
L’isotope samarium-153 est utilisé en médecine pour traiter les douleurs osseuses associées aux métastases cancéreuses. Il émet des particules bêta qui ciblent les tissus osseux affectés, réduisant la douleur tout en minimisant les dommages aux tissus sains.
Applications du Samarium
Applications Industrielles
Le samarium est un matériau clé dans plusieurs secteurs :
- Aimants permanents : Les aimants SmCo sont utilisés dans l’aérospatiale, l’automobile et l’électronique.
- Catalyseurs : Utilisé dans le craquage pétrolier et d’autres procédés chimiques.
- Alliages : Améliore la résistance des alliages dans les turbines et les réacteurs.
Applications Médicales
L’isotope samarium-153 est administré sous forme de samarium-153-lexidronam pour soulager les douleurs osseuses dans les cas de cancers métastatiques, notamment du sein et de la prostate. Ce traitement est efficace et bien toléré, avec des effets secondaires minimes.
Applications Scientifiques
Le samarium est utilisé dans la datation radiométrique (méthode samarium-néodyme) pour déterminer l’âge des roches et des météorites, contribuant à la compréhension de la formation de la Terre et du système solaire.
Effets Biologiques et Risques
Effets Moléculaires
L’exposition au samarium, en particulier sous forme radioactive, peut entraîner :
- Lésions de l’ADN : Par effet direct des rayonnements ou via la formation de radicaux libres.
- Anomalies chromosomiques : Risque accru en cas d’exposition prolongée.
- Mort cellulaire : À fortes doses, notamment pour les isotopes radioactifs.
- Transformation néoplasique : Risque potentiel de cancer à long terme.
Effets Pathologiques
Les effets du samarium radioactif sur le corps humain incluent :
- Peau : Rougeurs, desquamation ou, à long terme, risque de cancer cutané.
- Os : Possibilité de radionécrose ou de fractures.
- Organes internes : Risques d’insuffisance rénale ou hépatique en cas d’exposition excessive.
Précautions
L’utilisation du samarium, en particulier dans ses formes radioactives, nécessite des protocoles stricts pour minimiser les risques, notamment dans les applications médicales et industrielles.
Conclusion
Le samarium est un élément fascinant, à la croisée de la science des matériaux, de la médecine et de la géologie. Sa structure atomique complexe, ses méthodes de production sophistiquées et ses propriétés physiques, chimiques, magnétiques et optiques en font un matériau incontournable dans de nombreux domaines. Bien que son utilisation comporte des risques, notamment en raison de ses isotopes radioactifs, les avantages qu’il offre dans les technologies de pointe et les traitements médicaux sont indéniables. Une compréhension approfondie de ses caractéristiques permet d’optimiser son utilisation tout en garantissant la sécurité des utilisateurs.
Voici une sélection de livres:
- Guide pratique de chirurgie parodontale Broché – 19 octobre 2011
- Parodontologie Broché – 19 septembre 1996
- MEDECINE ORALE ET CHIRURGIE ORALE PARODONTOLOGIE
- Parodontologie: Le contrôle du facteur bactérien par le practicien et par le patient
- Parodontologie clinique: Dentisterie implantaire, traitements et santé
- Parodontologie & Dentisterie implantaire : Volume 1
- Endodontie, prothese et parodontologie
- La parodontologie tout simplement Broché – Grand livre, 1 juillet 2020
- Parodontologie Relié – 1 novembre 2005


Leave a Reply