Le Collagène, Parodontologie
Le Collagène, Parodontologie
Introduction
Le collagène constitue une famille de protéines fibreuses ; il est rencontré dans toutes les espèces animales et sécrété par les cellules du tissu conjonctif (et d’autres cellules). C’est la protéine la plus abondante dans le derme et l’os et la plus abondante chez les mammifères (25 % de la masse totale des protéines).
Définition
Le collagène est une glycoprotéine dont l’unité structurale est le tropocollagène. C’est le principal constituant extracellulaire des tissus conjonctifs, notamment les tissus conjonctifs parodontaux. Il procure le soutien mécanique aux tissus conjonctifs (résiste aux forces de tension).
Structure du Tropocollagène
Le tropocollagène est le monomère du collagène fibreux insoluble :
- Poids moléculaire (PM) = 300 000.
- Longueur de 2 800 à 3 000 Å.
- Largeur de 14 Å.
Il est constitué de trois chaînes polypeptidiques (chaînes α) enroulées en triple hélice, ayant chacune un PM = 96 000.
Caractéristiques de la Molécule de Collagène
Sa composition en acides aminés est particulière :
- 1/3 des acides aminés : glycine.
- 1/4 des acides aminés : proline + hydroxyproline.
- Le reste est constitué par :
- Alanine.
- Acides aminés polaires.
- Acides aminés non polaires.
- Hydroxyamino-acides : hydroxylysine.
Cette protéine diffère des protéines sériques par l’absence de tryptophane et sa faible teneur en acides aminés soufrés la distingue des kératines.
Chaîne Alpha de la Molécule de Collagène
- Une chaîne α comporte environ 1 000 acides aminés.
- 3 acides aminés par tour.
- Une glycine tous les 3 acides aminés.
- Motif répété : -(Gly-X-Y)- :
- X est souvent une proline.
- Y est souvent une hydroxyproline.
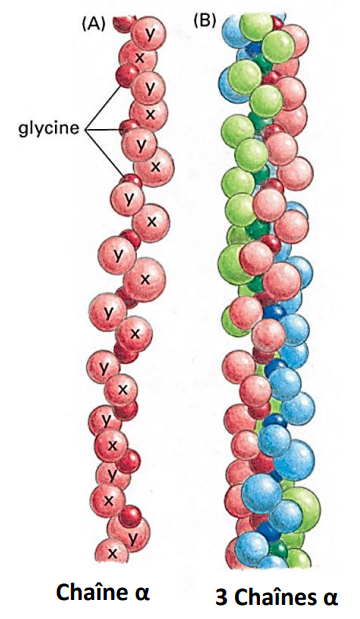
Image : Chaîne α et trois chaînes α enroulées en triple hélice (Source : Molecular Biology of the Cell, 4th Edition).
Typage du Collagène
En fonction de la répartition des acides aminés, on distingue cinq types de chaînes α :
- 4 chaînes α1.
- 1 chaîne α2.
En fonction de la répartition de ces cinq chaînes α au sein de la molécule, on décrit plusieurs types de collagène :
| Type | Formule Moléculaire | Forme Polymérisée | Distribution Tissulaire |
|---|---|---|---|
| Fibril-forming (fibrillar) | |||
| I | [α1(I)]₂α2(I) | Fibrille | Os, peau, tendons, ligaments, cornée, organes internes (représente 90 % du collagène corporel) |
| II | [α1(II)]₃ | Fibrille | Cartilage, disque intervertébral, notochorde, humeur vitrée de l’œil |
| III | [α1(III)]₃ | Fibrille | Peau, vaisseaux sanguins, organes internes |
| V | [α1(V)]₂α2(V) et α1(V)α2(V)α3(V) | Fibrille (avec type I) | Comme pour le type I |
| XI | α1(XI)α2(IX)α3(XI) | Fibrille (avec type II) | Comme pour le type II |
| Fibril-associated | |||
| IX | α1(IX)α2(IX)α3(IX) | Association latérale avec fibrilles de type II | Cartilage |
| XII | [α1(XI)]₃ | Association latérale avec certaines fibrilles de type I | Tendons, ligaments, certains autres tissus |
| Network-forming | |||
| IV | [α1(IV)]₂α2(IV) | Réseau en feuillet | Lame basale |
| VII | [α1(VII)]₃ | Fibrilles d’ancrage | Sous les épithéliums squameux stratifiés |
| Transmembrane | |||
| XVII | [α1(XVII)]₃ | Non connu | Hémidesmosomes |
| Others | |||
| XVIII | [α1(XVIII)]₃ | Non connu | Lame basale autour des vaisseaux sanguins |
Note : Les types I, IV, V, IX et XI sont composés de deux ou trois types de chaînes α, tandis que les types II, III, VII, XII, XVII et XVIII sont composés d’un seul type de chaîne α. Seuls 11 types de collagène sont présentés, mais environ 20 types de collagène et 25 types de chaînes α ont été identifiés.
Biosynthèse du Collagène
Le collagène est synthétisé par le fibroblaste, cellule de base des tissus conjonctifs mous, principalement rencontré au niveau de :
- La pulpe.
- Le desmodonte.
- Le chorion gingival.
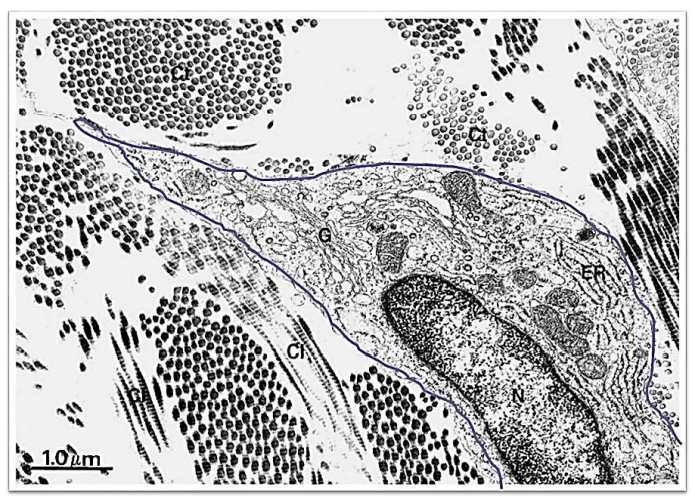
Image : Aspect microscopique du fibroblaste.
Les fibroblastes sont des cellules possédant une activité intense et capables de se mobiliser à l’intérieur de la matrice extracellulaire ou à la surface d’un substrat (ex. : verre ou plastique des flacons de culture). Au repos, leur taille diminue et ils prennent le nom de fibrocytes.
La synthèse fait appel aux différents organites cellulaires :
- Réticulum endoplasmique granulaire (R.E.G).
- Appareil de Golgi.
- Vésicules d’exocytose.
Au Niveau du R.E.G
- Synthèse des acides aminés + assemblage en chaînes polypeptidiques pro-α.
- Hydroxylation des acides aminés :
- Lysine → Hydroxylysine (par lysine hydroxylase).
- Proline → Hydroxyproline (par proline hydroxylase).
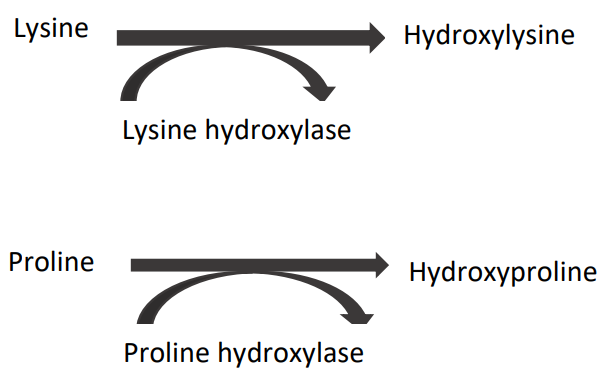
En présence de l’oxygène sanguin et de la vitamine C. Les chaînes pro-α présentent à leurs extrémités des peptides de coordination, riches en acides aminés soufrés. Ces peptides lient les chaînes pro-α à leurs deux extrémités par groupes de trois par des ponts disulfures, formant ainsi une molécule de procollagène organisée en triple hélice.
Au Niveau de l’Appareil de Golgi
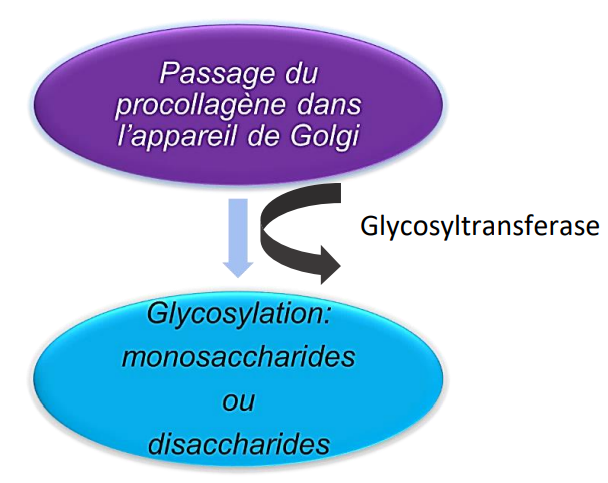
Au Niveau des Vésicules d’Exocytose
Ces vésicules proviennent de la fragmentation des extrémités de l’appareil de Golgi. Elles ont une forme plus ou moins arrondie et se dirigent vers la membrane cytoplasmique pour déverser leur contenu dans le milieu extracellulaire.
Franchissement de la Membrane Cytoplasmique
Les vésicules se mettent en contact avec la membrane cytoplasmique, s’ouvrent sur le milieu extracellulaire et déversent leur contenu après le clivage des peptides de coordination par une enzyme membranaire appelée procollagène-peptidase. À ce moment, le procollagène devient du tropocollagène.
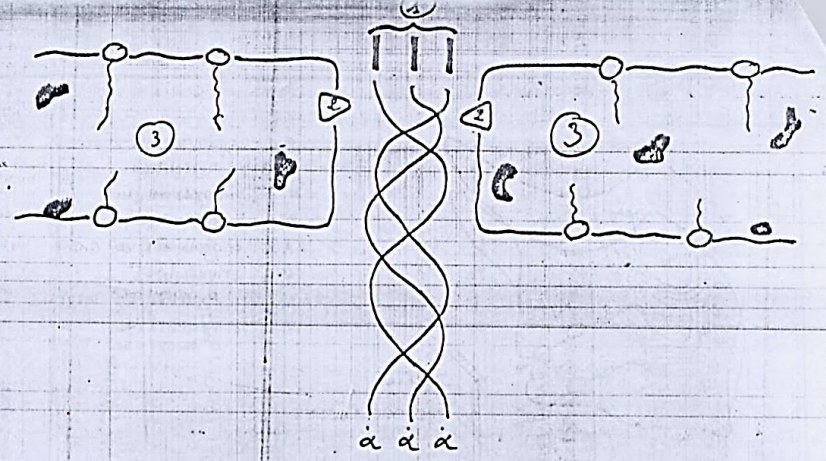
Image : Franchissement de la membrane cytoplasmique et clivage des peptides de coordination (montrant les peptides de coordination, la procollagène peptidase, et la membrane cytoplasmique).
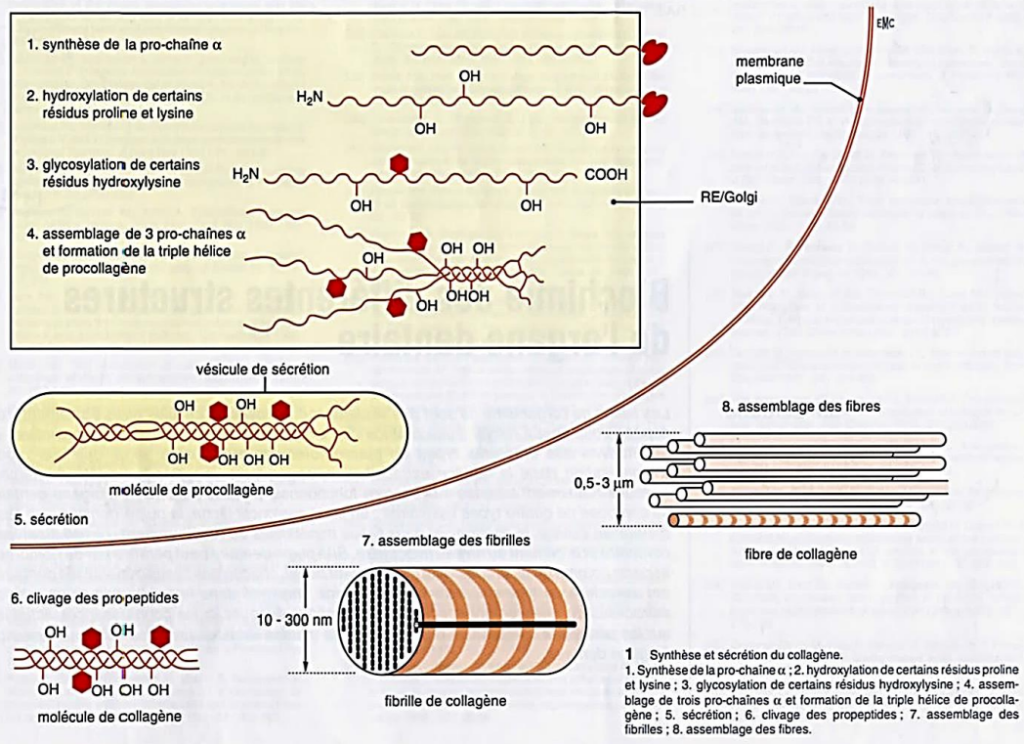
Image : Schéma de la biosynthèse du collagène.
Maturation du Collagène
La maturation consiste en la transformation du collagène natif ou tropocollagène en un collagène mature insoluble par augmentation des liaisons intra- et intermoléculaires.
Transformation de la Molécule de Tropocollagène

Au cours de cette phase, les molécules de tropocollagène s’attachent entre elles par des liaisons intermoléculaires (cross-links) de type réaction de Schiff, formant des fibrilles (200 à 2 000 Å de diamètre). En microscopie électronique, les fibrilles de collagène présentent des striations transversales d’une périodicité de 680 Å, reflétant l’arrangement des molécules de collagène individuelles dans la fibrille. Chaque molécule est décalée de la molécule adjacente sur 1/4 de sa longueur. Les fibrilles s’assemblent pour former des fibres, qui confluent pour former des faisceaux de fibres.
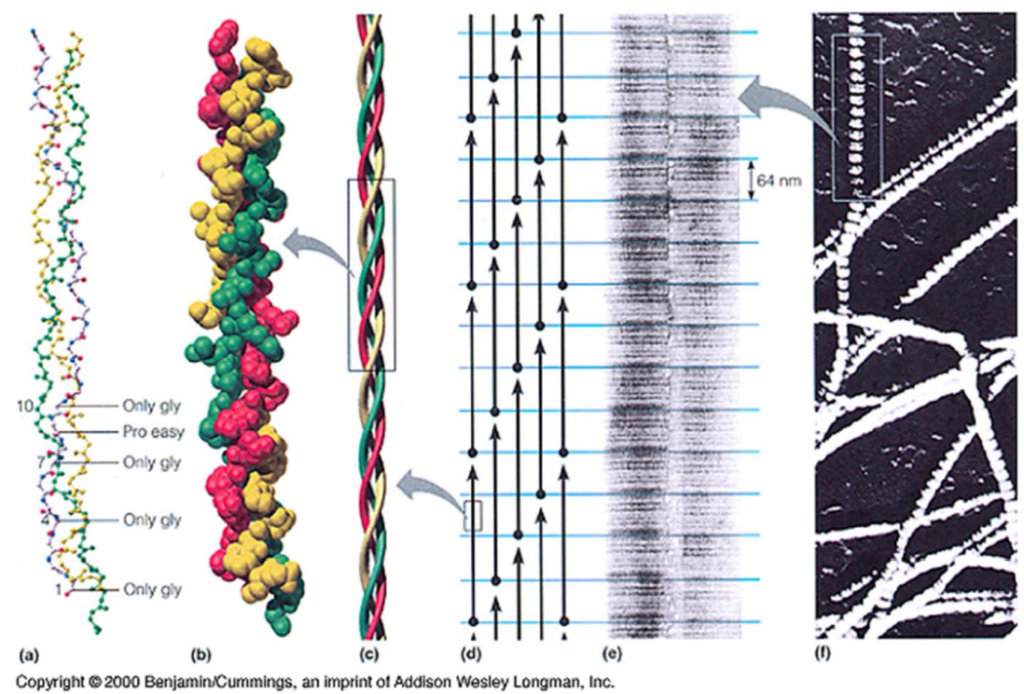
Image : Fibres de collagène montrant la striation transversale.
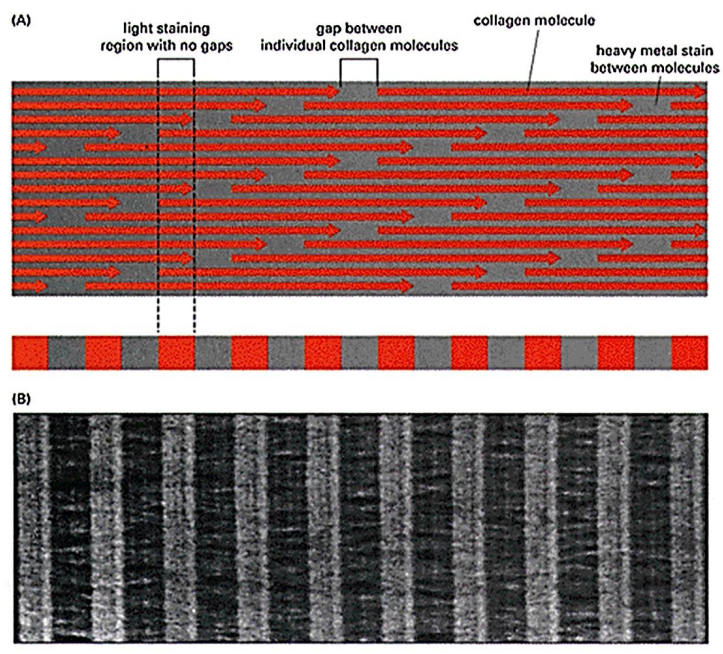
Image : Explication moléculaire de la striation périodique observée en microscopie électronique.
Interaction entre les Fibrilles de Collagène et les Molécules de la Substance Fondamentale
Ces molécules incluent :
- Glycosaminoglycanes (GAG) : polymères d’unités disaccharidiques composées d’un acide uronique + une hexoamine (ex. : acide hyaluronique, chondroïtine sulfate).
- Protéoglycanes (PG).
Leur liaison avec des protéines au sein de la substance fondamentale contribue à la formation de PG. Ces derniers s’attachent aux fibrilles et aux fibres de collagène par le biais de leurs chaînes saccharidiques, augmentant la réticulation et l’insolubilité du collagène.
Note : Ces PG peuvent être reliés entre elles par une molécule de GAG de type acide hyaluronique.
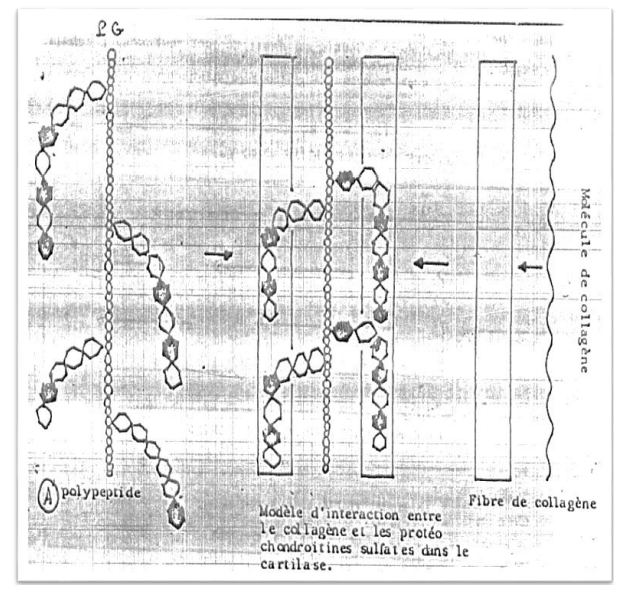
Image : Interaction entre une molécule de collagène et un protéoglycane.
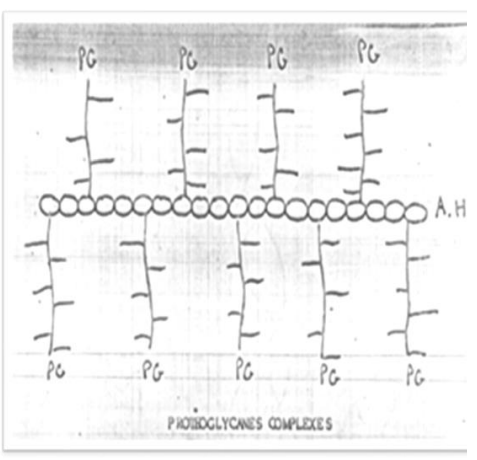
Image : Protéoglycanes complexes.
Turnover du Collagène
Le turnover est le renouvellement permanent d’une partie du collagène, consistant en une dégradation suivie d’une synthèse de nouvelles molécules de collagène. Sa rapidité varie d’un tissu à un autre ; par exemple, le collagène du ligament alvéolo-dentaire (LAD) est renouvelé 5 fois plus vite que celui de la gencive, et celui de l’os alvéolaire 15 fois plus vite que celui de la peau. Ce mécanisme physiologique ralentit considérablement avec l’âge.
Dégradation du Collagène
Dégradation Physiologique
La dégradation physiologique du collagène est partielle, maintenant un équilibre entre synthèse et destruction. Elle fait appel à deux mécanismes principaux :
- Mécanisme phagocytaire.
- Mécanisme enzymatique.
Mécanisme Phagocytaire
La phagocytose permet à une cellule d’absorber un élément extracellulaire solide et de le digérer. Elle fait intervenir :
- La membrane cytoplasmique, qui forme des phagosomes contenant le corps phagocyté.
- Les lysosomes, qui contiennent des enzymes hydrolytiques.
Le fibroblaste, responsable de la synthèse et de la dégradation du collagène, invagine sa membrane cytoplasmique pour former un phagosome recouvert de collagénase, qui clive la molécule de collagène, la rendant digeste pour les enzymes hydrolytiques du phagolysosome, où le collagène est complètement détruit.
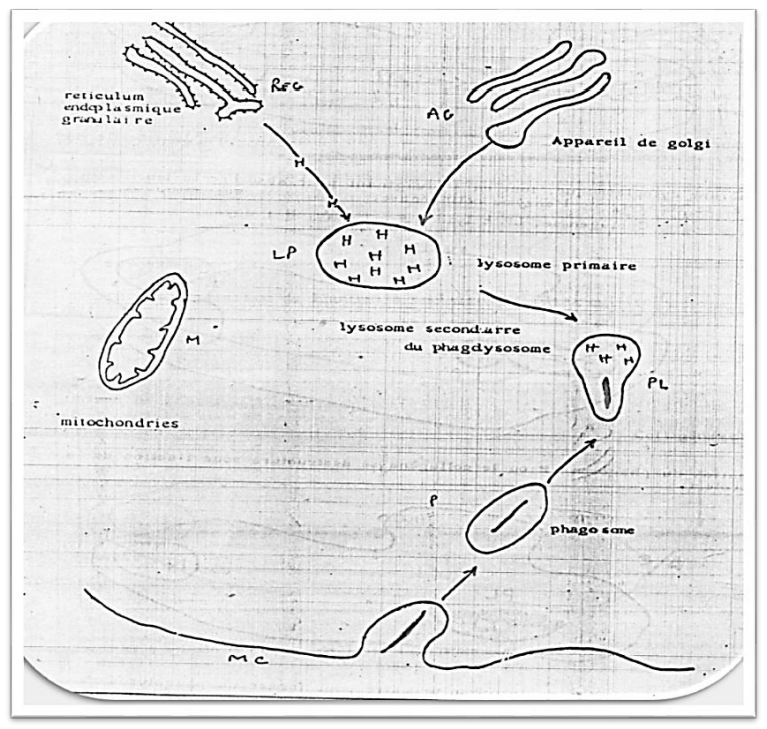
Image : Dégradation du collagène par le mécanisme phagocytaire (montrant le réticulum endoplasmique granulaire, l’appareil de Golgi, la mitochondrie, le lysosome primaire, et le phagolysosome).
Mécanisme Enzymatique
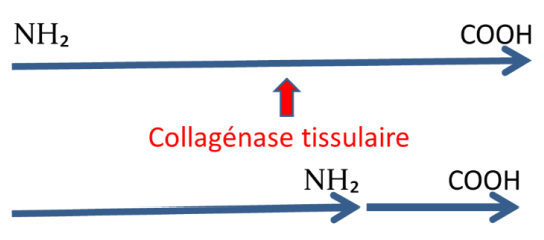
Dans des conditions physiologiques, le collagène peut être dégradé par une enzyme tissulaire : la collagénase tissulaire. Présente dans le milieu extracellulaire sous une forme inactive (procollagénase), elle est activée par des activateurs pour devenir collagénase tissulaire vraie, et peut redevenir inactive sous l’influence d’inhibiteurs. À un pH = 7 et une température = 37 °C, la collagénase tissulaire coupe la molécule de collagène natif en deux fragments d’inégale longueur :
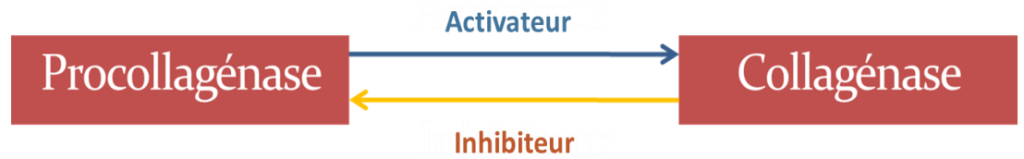
- ¾ de la longueur contient le terminal NH₂.
- ¼ de la longueur contient le terminal COOH.
Ces fragments sont ensuite métabolisés par des enzymes protéolytiques en peptides, puis en acides aminés.
Mécanisme de Régulation
La régulation de l’activité collagénolytique dépend de :
- Type de collagène (le type II est plus résistant que le type I).
- Âge de la molécule de collagène (augmentation des cross-links intra- et intermoléculaires).
- Variations du pH et de la température.
- Certaines hormones.
Note : Le collagène natif est détruit par le mécanisme enzymatique, tandis que le collagène insoluble réticulé est détruit par phagocytose.
Dégradation Pathologique
Dans la dégradation pathologique, le collagène est totalement détruit, rompant l’équilibre synthèse/destruction au profit de la destruction. Elle peut être liée à :
- Une amplification des mécanismes enzymatiques.
- Une accélération du mécanisme phagocytaire.
Augmentation de la Dégradation selon le Mode Enzymatique
- Peut être spontanée par augmentation de la sécrétion de collagénase tissulaire.
- Par afflux d’éléments cellulaires porteurs de collagénase (polynucléaires, macrophages, certaines bactéries).
L’augmentation de la sécrétion de collagénase tissulaire peut être liée à :
- Une diminution quantitative des inhibiteurs.
- Une augmentation des activateurs.
La sécrétion de collagénase tissulaire est intense en cas d’inflammation. L’afflux d’éléments cellulaires porteurs de collagénase est lié à certaines bactéries impliquées dans la destruction du collagène, comme Bacteroides melaninogenicus, qui agit directement par sa propre collagénase ou indirectement par ses endotoxines activant la collagénase osseuse. La plupart des bactéries impliquées dans la maladie parodontale sécrètent des enzymes protéolytiques dégradant les peptides issus du fractionnement des chaînes α. Les leucocytes polynucléaires, dont le nombre augmente lors d’une inflammation, sécrètent une collagénase hydrolysant le collagène natif. Les macrophages contribuent également à la destruction du collagène dans la maladie parodontale par leur propre collagénase.
Augmentation de l’Activité Phagocytaire
Cette augmentation se produit par :
- Les macrophages, dont le nombre augmente en cas d’inflammation, augmentant leur phagocytose et activité collagénolytique.
- Les fibroblastes, qui phagocytent le collagène en plus grande quantité en période inflammatoire.
Conclusion
- Le collagène est une glycoprotéine fibreuse.
- Il est sécrété par les fibroblastes.
- Il est assemblé à l’extérieur des cellules dans la matrice extracellulaire.
- Il se retrouve dans tous les tissus conjonctifs.
- Il se résorbe dans l’organisme sous l’influence de mécanismes phagocytaires et enzymatiques.
- Une pathologie survient lorsque la résorption est trop importante par rapport à la synthèse, suivant les mêmes mécanismes que la résorption physiologique.




Leave a Reply