Consultation d’Anesthésie – Anesthésiologie Dentaire
Consultation d’Anesthésie – Anesthésiologie Dentaire
Introduction
La première étape de la recherche en matière de sécurité et de qualité des actes anesthésiques consiste d’abord à « faut écrire ce que l’on veut faire ». Cela revient, à ériger, de manière consensuelle, des normes de bonnes pratiques anesthésiques.
La majorité de pays développés avait, depuis plusieurs années, rédigé des standards de bonnes pratiques anesthésiques, tels qu’aux USA, en Allemagne, en Suisse, en Belgique, au Royaume Uni, en Suède, etc… En France, le décret ministériel n94 – 1050 du 05 décembre 1994 relatif aux conditions techniques de fonctionnement des établissements de santé en ce qui concerne la pratique de l’anesthésie et modifiant le code de la(Common Voice Dataset santé publique, a rendu obligatoire la consultation d’anesthésie.
Au C.H.U. de Constantine, depuis le $1^{\text{er}}$ mars 1996, le département d’anesthésie-réanimation chirurgicale a mis en activité la consultation préanesthésique à distance de l’acte opératoire et qui reste non obligatoire.
Examen Préopératoire
La place qu’occupe l’examen pré-opératoire est d’évaluer les différents problèmes qui conditionnent le protocole d’anesthésie en fonction de l’acte chirurgical, de confronter ou de rassurer le malade.
La première étape de cette place se résume dans l’importance qui s’attache à l’examen préopératoire qui ne se limite pas à une prise de contact destiné à prescrire une prémédication, ni à un résumé du dossier du malade présenté par le chirurgien. C’est donc, dans ce cadre de véritables consultations de pré-anesthésies que le médecin anesthésiste réanimateur réalise pleinement son activité de praticien. Cet examen pré-opératoire a deux objectifs :
- L’information du patient sur le déroulement de l’anesthésie à l’occasion d’une première prise de contact avec le médecin anesthésiste.
- L’évaluation du passé médical et de l’état actuel du patient qui va être soumis à l’anesthésie pour être opéré. Au terme de cet examen le médecin peut d’une part évaluer le risque anesthésique et chirurgical et d’autre part, choisir une conduite thérapeutique qui couvre les trois périodes de l’acte opératoire (préparation et prémédication, anesthésie, suites opératoires) afin de, diminuer la morbidité et la mortalité opératoires liées à telle ou telle affection dont il est porteur le patient.
Dans cette approche l’examen pré-opératoire va comprendre quatre volets :
- Un contact psychologique fondamental pour le praticien : Dans cette prise de contact, il y a un contrat entre l’anesthésiste et le patient.
- Une enquête anamnestique qui permettra de préciser les antécédents, soit de d’identifier une pathologie méconnue (anomalie de l’hémostase) qui va se manifester par le saignement soit de préciser le retentissement d’une pathologie déjà connue par le patient ayant une incidence sur le déroulement anesthésique (cardiopathie ischémique, insuffisance rénale chronique, insuffisance respiratoire chronique) avec les différentes thérapeutiques auxquelles il est soumis, par un questionnaire d’évaluation du passé médical du patient.
- Un examen somatique clinique général et complet qui consiste à révéler des difficultés d’intubation prévisibles, d’éventuels problèmes cardio-vasculaires, pulmonaires etc…
- Enfin la prise de connaissance des différents examens et éventuellement la prescription pré-opératoire raisonnée des examens para-cliniques complémentaires où leurs places se résument généralement dans la participation de l’estimation ASA (80 % des patients sont ASA I) et le dépistage des cardiopathies ischémiques asymptomatiques avec l’ECG. Il faut que la sensibilité et la spécificité de l’examen pratiqué soit suffisante pour l’affection considérée. Ces examens complémentaires doivent être prescrits au terme d’une approche clinique attentive selon une stratégie sélective adaptée à chaque contexte. Donc la seule obligation médico-légale est d’examiner les patients avant l’intervention et de prescrire des examens en tenant compte au mieux de l’état actuel des connaissances de notre spécialité. Il faut être clair, il n’y a aucune obligation médico-légale à la prescription systématique d’examens complémentaires dans le cadre du bilan pré-opératoire.
Stratégie des Examens Complémentaires
Après un examen clinique complet et en fonction de l’âge, des antécédents et de l’intervention projetée, l’on peut proposer une stratégie de prescription des examens complémentaires plus sélective.
- Groupe sanguin et recherche d’anticorps anti-érythrocytaires : le groupage sanguin n’est indispensable que pour les actes comportant un risque hémorragique. La recherche des agglutinines irrégulières est prescrite systématiquement avant toute transfusion.
- Exploration simplifiée de l’hémostase : le bilan d’hémostase simplifié est prescrit dans toutes les circonstances où les perturbations acquises de l’hémostase sont fréquentes (affection hépatique, rétention biliaire, affections néoplasiques, dénutrition…) et en cas de traitement anticoagulant. Lorsque l’interrogatoire fait suspecter une tendance hémorragique, le bilan sera complété par un temps de saignement et une numération plaquettaire.
- Formule de numération sanguine FNS : demandée en cas de syndrome anémique clinique, de maladie hématologique, de radiothérapie, de chimiothérapie, d’insuffisance rénale chronique, dans les situations impliquant la demande du groupe sanguin en chirurgie hémorragique ou potentiellement hémorragique, également pour le dépistage des hémoglobinopathies.
- Biochimie sanguine :
- Créatininémie, urée sanguine : la fonction rénale est précisée dans les affections néphrologiques, urologiques, HTA, diabète, états septiques, âge > 70 ans.
- Ionogramme sanguin : ses principales indications sont les perturbations métaboliques aiguës, prise de diurétiques, de corticoïdes, digitaliques, âge > 70 ans.
- Glycémie à jeun : elle est indiquée chez le diabétique, en cas de prise de corticoïdes, hypoglycémie, obésité, maladies endocriniennes.
- Électrocardiogramme : s’il existe des signes cliniques d’atteinte cardio-vasculaire chez les patients de plus de 40 ans et dans les situations à haut risque thromboembolique. Si un ECG antérieur est anormal.
- Radiographie du thorax : en cas de maladies pulmonaires chroniques, antécédents d’atteinte pulmonaire ou une pathologie qui peut avoir un retentissement pulmonaire.
- Certains examens spécifiques : à la pathologie existante (échocardiographie avec fraction d’éjection, radiographie du cou, rachis dorso-lombaire…).
Évaluation du Risque Opératoire
Définition du Risque Anesthésique
Le risque anesthésique se définit comme la probabilité pour un sujet de présenter une complication liée à l’anesthésie.
Le risque définissant la survenue d’un accident avec une fréquence plus ou moins aléatoire est un concept statistique dont l’application à un individu sain, ou à un acte chirurgical rarement compliqué est discutable.
La notion de risque est surtout applicable et utile en cas d’antécédents pathologiques ou de chirurgie majeure s’accompagnant de complications fréquentes.
Selon la cause identifiée ou supposée, les accidents opératoires sont habituellement classés en accidents totalement ou partiellement liés à l’anesthésie, à la chirurgie ou à la pathologie du patient.
Il faut distinguer l’ambiguïté de la définition du risque opératoire puisqu’il s’agit d’un risque cumulé, son analyse ne permettant pas toujours de distinguer la composante anesthésique de la composante chirurgicale.
Facteurs du Risque Anesthésique
Le risque opératoire dépend de nombreux facteurs plus ou moins difficiles à quantifier : pathologie et intervention chirurgicale, expérience de l’anesthésiste et état clinique du patient. Les causes structurelles du risque opératoire liées à l’environnement ne peuvent être ignorées.
La disparité du matériel et son absence de standardisation favorisent également les accidents.
Certains facteurs sont plus conjoncturels, faisant intervenir le choix de la technique anesthésique (installation per-opératoire, contrôle des voies aériennes, utilisation des drogues anesthésiques…) et des facteurs humains (fatigue, vigilance, expérience…).
Risque Lié au Patient et à la Chirurgie
La mortalité opératoire est étroitement corrélée à l’état clinique et au type de chirurgie. La mortalité opératoire dépend étroitement du type d’intervention, les chirurgies à risque étant la chirurgie intracrânienne, thoracique, cardio-vasculaire et sus-ombilicale.
L’association de plusieurs antécédents pathologiques augmente le risque et l’urgence le multiplie par trois.
Les facteurs favorisants : âge, la classe ASA, la durée d’intervention, le caractère d’urgence, le nombre d’affections associées, la présence dans les antécédents d’une anesthésie avec complication.
La façon la plus simple d’évaluer l’état pré-opératoire est la classification élaborée par l’American Society of Anesthesiologists « ASA » :
Classification de l’American Society of Anesthesiologists « ASA »
- Classe I : Patient en bonne santé.
- Classe II : Patient présentant une atteinte modérée d’une grande fonction.
- Classe III : Patient ayant une atteinte sévère d’une grande fonction qui n’entraîne pas d’incapacité.
- Classe IV : Patient ayant une atteinte sévère d’une grande fonction, présentant une menace vitale permanente.
- Classe V : Patient moribond, dont l’espérance de vie sans intervention chirurgicale est inférieure à 24 heures.
- Classe VI : Patient en état de mort cérébrale, dont les organes font l’objet d’un prélèvement en vue de greffe.
- « U » caractère Urgent : Si l’intervention est pratiquée en urgence, on rajoute à la classe considérée.
Bien que cette classification évalue l’état du patient et non le risque chirurgical, il y a une assez bonne corrélation entre l’état préopératoire et le risque (Voir nouvelle classification 2020).
Détection des Facteurs Prédictifs d’une Intubation Difficile par l’Examen Clinique
- Apprécier la mobilité cervicale : distance cartilage thyroïde-menton (cou en hyper extension) si < 6 cm : Attention !
- Apprécier l’ouverture de bouche : si < 35 mm (homme) ou < 30 mm (femme) : Attention !
- Apprécier la visibilité des structures pharyngées (qui semble étroitement corrélée à la facilité de laryngoscopie).
- Apprécier la mobilité cervicale : distance cartilage thyroïde-menton (cou en hyper extension) si < 6 cm : Attention !
Détection des Facteurs Prédictifs d’une Ventilation Difficile par l’Examen Clinique
- Présence d’une barbe.
- IMC > 26 kg/m².
- Édenté.
- Âge > 55 ans.
- Histoire de ronflement.
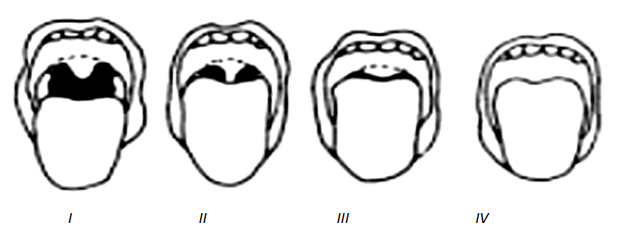
Classification de Mallampati
- Classe I : Luette, voile du palais, piliers du voile vus.
- Classe II : Pointe de luette masquée, piliers du voile vus.
- Classe III : Seul le voile du palais est vu.
- Classe IV : Seul le palais osseux est vu.
- Classe II : PRUDENCE
- Classe III & IV : DANGER
Évaluation du Risque Cardiaque (en Chirurgie Non Cardiaque)
Score de Goldman
- 11 points : Galop droit (B3) ou turgescence jugulaire (IVD).
- 10 points : Infarctus du myocarde datant de moins de 6 mois.
- 7 points : Rythme cardiaque autre que sinusal ou ESV.
- 7 points : Plus de 5 ESV par minute.
- 5 points : Âge supérieur à 70 ans.
- 4 points : Intervention en urgence.
- 3 points : Sténose aortique significative.
- 3 points : Siège de l’intervention : intra-péritonéale, intra-thoracique, aorte.
- 3 points : Alitement prolongé préopératoire de cause non cardiaque, anomalies biologiques : PaO2 < 60 mm Hg, PaCO2 > 50 mm Hg, K+ < 3 mEq/l, HCO3- < 20 mEq/l, insuffisance hépatique, urée > 10 mmole/l ou > 0,60 g/l, créatinine > 270 micromoles/l ou > 30 g/l.
- Total : 53 points
Score de Goldman : Accidents et Décès de Cause Cardiaque
- 0 à 5 points : 0,7 % d’accidents, 0,2 % de décès.
- 6 à 12 points : 5 % d’accidents, 2 % de décès.
- 13 à 25 points : 11 % d’accidents, 2 % de décès.
- 25 points : 22 % d’accidents, 56 % de décès.
Score de Lee
Évaluation Préopératoire des Antécédents du Patient par le Calcul du Score de Lee Classique à Six Items et du Score de Lee Clinique à Cinq Items
Il est préférable d’utiliser le score de Lee clinique et d’évaluer séparément le risque lié à la chirurgie.
Score de Risque Cardiaque de Lee
- Calcul du Score de Lee Classique :
- 1 point : Chirurgie à haut risque définie par une chirurgie vasculaire suprainguinale, intrathoracique ou intrapéritonéale.
- 1 point : Coronopathie définie par un antécédent d’infarctus du myocarde, un angor clinique, une utilisation de nitrés, une onde Q sur ECG ou un test non invasif.
- 1 point : Insuffisance cardiaque.
- 1 point : Accident vasculaire cérébral ou accident ischémique transitoire.
- 1 point : Diabète insulino-dépendant.
- 1 point : Insuffisance rénale (créatinine > 2 mg/dl).
- Calcul du Score de Lee Clinique :
- 1 point : Coronopathie définie par un antécédent d’infarctus du myocarde, un angor clinique, une utilisation de nitrés, une onde Q sur ECG ou un test non invasif.
- 1 point : Insuffisance cardiaque.
- 1 point : Accident vasculaire cérébral ou accident ischémique transitoire.
- 1 point : Diabète insulino-dépendant.
- 1 point : Insuffisance rénale (créatinine > 2 mg/dl).
Accidents Anesthésiques
Lorsque l’anesthésie est totalement ou partiellement responsable d’un accident, les causes les plus fréquentes sont :
- Défauts d’organisation du travail.
- Défaillances techniques de l’appareil et du matériel.
- Effets secondaires des drogues anesthésiques.
- Erreurs humaines (ignorance, mauvaise utilisation des connaissances, inexpérience, travail non consciencieux, fatigue, surmenage…).
Gestion Péri-opératoire des Traitements Chroniques et Dispositifs
Plusieurs millions d’anesthésies sont réalisées chaque année dans le monde, alors que le nombre de patients recevant des médicaments ne cesse de s’accroître. La polymédication est également très fréquente. Alors que l’on aurait pu s’attendre à un accroissement des interférences pharmacologiques avec l’anesthésie, la plupart des médicaments administrés aux patients peuvent être poursuivis au cours de la période péri-opératoire. Les progrès constants de la discipline, dans tous les domaines et en particulier en pharmacologie, contribuent largement à cette situation. La consultation d’anesthésie, est-il besoin de le rappeler, tient ici une place prépondérante.
Médicaments Cardiovasculaires
Les pathologies cardiovasculaires sont les principales causes de morbidité et de mortalité dans les pays développés. Il n’est donc pas étonnant de constater que les patients consultant en anesthésie ont très fréquemment un traitement à visée cardiovasculaire.
Bêtabloquants
Les indications des bêtabloquants incluent l’hypertension artérielle, la pathologie coronarienne, les troubles du rythme et, plus récemment, l’insuffisance cardiaque. Les bêtabloquants réduisent la fréquence et le débit cardiaque, ainsi que la demande en oxygène du myocarde.
Un traitement par bêtabloquants, institué et poursuivi pendant toute cette période, limite la fréquence de survenue d’événements ischémiques et réduit la mortalité, ils doivent être maintenus jusqu’au matin de l’intervention chirurgicale.
Dérivés Nitrés
Les dérivés nitrés et la molsidomine exercent leur action anti-ischémique par la combinaison d’effets vasodilatateurs veineux (diminution de la précharge), artérielle (diminution de la postcharge) et coronaire. Chez les malades souffrant d’une maladie coronaire nécessitant l’administration de dérivés nitrés, il faut envisager une évaluation invasive de la maladie coronaire. Il faut préciser que nous ne disposons pas d’étude clinique démontrant un avantage à la poursuite d’un traitement par dérivés nitrés administré de façon chronique. Toutefois, compte tenu de leurs propriétés et de leur indication anti-ischémique myocardique, cette classe de médicaments suit les mêmes recommandations que les bêtabloquants. Ils doivent donc être poursuivis en période péri-opératoire, en gardant à l’esprit qu’il existe une diminution de l’efficacité de la voie transdermique en cas de baisse du débit de perfusion cutanée.
Inhibiteurs Calciques
L’effet prédominant des inhibiteurs calciques est une vasodilatation du lit vasculaire, artérielle et coronaire. Ils réduisent la demande en oxygène par réduction de la postcharge. Les inhibiteurs calciques contribuent à améliorer l’équilibre hémodynamique et à limiter la demande en oxygène du myocarde, mais avec moins d’efficacité que les bêtabloquants. La poursuite des inhibiteurs calciques durant toute la période péri-opératoire est habituellement recommandée.
Inhibiteurs de l’Enzyme de Conversion et Antagonistes des Récepteurs à l’Angiotensine
Les risques et les bénéfices des antagonistes du système rénine-angiotensine (SRA), inhibiteurs du SRA et antagonistes des récepteurs à l’angiotensine, ont fait l’objet d’une revue générale. L’angiotensine II intervient dans la régulation à court terme de la pression artérielle, dans la distribution des volumes plasmatiques et des circulations régionales. Les inhibiteurs de l’enzyme de conversion (IEC) inhibent la formation de l’angiotensine II et augmentent la production de bradykinine, un puissant vasodilatateur, à l’origine de certains effets indésirables comme la toux. Les antagonistes des récepteurs à l’angiotensine II (AAII) interviennent exclusivement en bloquant ces récepteurs sans participer directement à la formation de bradykinine. Les indications thérapeutiques comprennent principalement l’hypertension artérielle, l’insuffisance cardiaque et le post-infarctus.
Chez les patients hypertendus et traités de façon chronique par un IEC ou un AAII, les épisodes d’hypotension artérielle sont très fréquents et tout particulièrement à l’induction. Pour les IEC, le mécanisme impliqué est la réduction de la précharge ventriculaire gauche. De façon évidente, le risque est majoré chez les patients soumis à l’effet d’autres antihypertenseurs.
Les données de la littérature sont suffisantes pour préconiser, chez les patients traités pour hypertension, l’arrêt des antagonistes du SRA avant une anesthésie. Cette précaution doit être particulièrement respectée pour toute chirurgie hémorragique et pour la réalisation d’une anesthésie médullaire, deux situations où la variation de la volémie efficace est importante.
Chez les patients en insuffisance cardiaque, le maintien des antagonistes du SRA avant une anesthésie apparaît souhaitable compte tenu de leurs effets bénéfiques sur la fonction ventriculaire gauche. Toutefois, les études sont encore trop peu nombreuses à ce jour pour conclure définitivement sur l’attitude à adopter.
Antiarythmiques
L’utilisation des antiarythmiques en anesthésie a fait l’objet d’une conférence d’actualisation. Pour justifier l’arrêt des antiarythmiques avant une anesthésie, il faut démontrer l’utilité d’une telle mesure comparée au risque de récurrence de troubles du rythme péri-opératoires. Compte tenu des effets indésirables de ces molécules, leur prescription et leurs indications sont toujours raisonnées et justifiées.
Les antiarythmiques de classe I ont perdu beaucoup de leurs indications du fait de la morbidité et de la mortalité liées à leurs effets pro-arythmiques. Il est souhaitable de les interrompre en période préopératoire. Pour d’autres molécules, comme l’amiodarone, la longue demi-vie d’élimination rend illusoire la possibilité d’interrompre le traitement. Les interférences avec l’anesthésie posent peu de problèmes en pratique, même si les possibilités d’adaptation hémodynamique sont réduites (dépression myocardique, bradycardie). L’attitude communément admise est donc de poursuivre le traitement jusqu’au matin de l’intervention.
Diurétiques
Les diurétiques exposent les patients aux dyskaliémies et à l’hypovolémie. Le plus simple est de les arrêter avant toute intervention chirurgicale et de vérifier l’absence d’anomalies métaboliques.
Agonistes A2
Ils apportent un bénéfice sur l’équilibre hémodynamique per- et postopératoire et un effet protecteur sur l’ischémie myocardique. Un arrêt du traitement, même de courte durée, est suffisant pour entraîner un effet rebond délétère. Il est habituellement préconisé de ne pas interrompre ce traitement, mais cette classe de médicament est peu administrée en cardiologie.
Digitaliques
Les digitaliques augmentent la contractilité myocardique et ralentissent la conduction auriculo-ventriculaire, d’où leurs deux indications : insuffisance cardiaque et troubles du rythme supraventriculaire. Il est conseillé de disposer d’un dosage plasmatique récent et de rechercher, de principe, des signes cliniques de surdosage car l’intervalle thérapeutique de ces molécules est étroit. Il est toujours difficile, en présence d’un trouble du rythme, de l’attribuer à un surdosage ou à un événement intercurrent, car toutes les formes ont été décrites. Une attention particulière doit être portée sur les principaux facteurs favorisant une intoxication digitalique : hypokaliémie, acidose et insuffisance rénale. Le traitement digitalique ne doit pas être interrompu, mais la demi-vie de la Digoxine® est longue, offrant une certaine souplesse, que ce soit en période pré- ou postopératoire.
Antiplaquettaires
La prise en charge des agents antiplaquettaires dans la période péri-opératoire a fait l’objet d’une conférence d’experts en 2001, disponible sur le site Internet de la Sfar (www.sfar.org). Les lignes qui suivent en font un simple rappel.
Les agents antiplaquettaires (AAP) sont des médicaments capables d’inhiber les fonctions plaquettaires. Les AAP actuellement disponibles sont l’aspirine, le dipyridamole, les thiénopyridines (ticlopidine et clopidogrel), et les antagonistes du récepteur plaquettaire αIIbβ3 (GPIIb-IIIa). L’aspirine inhibe la production plaquettaire de thromboxane A2, puissant inducteur de l’agrégation, en inhibant de façon irréversible la cyclo-oxygénase plaquettaire. Les autres anti-inflammatoires non stéroïdiens (AINS), parmi lesquels le flurbiprofène, inhibent la cyclo-oxygénase de façon réversible. La ticlopidine et le clopidogrel inhibent, par l’intermédiaire de leurs métabolites actifs, l’agrégation plaquettaire induite par l’ADP en modifiant de façon irréversible l’un des récepteurs plaquettaires de l’ADP. L’activation à la surface plaquettaire du récepteur αIIbβ3 (GPIIb-IIIa) permet l’agrégation des plaquettes. Les antagonistes de ce récepteur sont soit des anticorps (abciximab), soit des analogues (eptifibatide, tirofiban) qui entrent en compétition avec le fibrinogène et aussi avec le facteur Willebrand.
Chez les patients ayant une pathologie cérébrovasculaire ou coronaire, un traitement par AAP au long cours par aspirine est recommandé. Il ne peut être arrêté en période péri-opératoire que lorsque le risque hémorragique spécifique à la chirurgie paraît nettement supérieur au risque cardiovasculaire lié à l’arrêt (en particulier au risque de syndrome coronaire aigu). Cependant, le risque exact lié à l’arrêt des AAP en période péri-opératoire chez des coronariens est mal connu.
En l’absence d’étude validée pour chaque cas, on doit tenir compte de la technique chirurgicale et anesthésique, de la possibilité du contrôle de l’hémostase et du risque cardiovasculaire spécifique. Aucun test d’exploration de l’hémostase primaire ne présente de valeur prédictive du risque hémorragique.
Lorsque l’interruption d’un traitement par AAP est jugée indispensable, la durée de l’interruption pour l’aspirine, la ticlopidine et le clopidogrel, est en pratique courante de 10 jours. Le risque cardiovasculaire lié à l’interruption d’un traitement par AAP doit inciter à une reprise postopératoire précoce en utilisant des agents ayant une action antiplaquettaire ou antithrombotique réversible à court terme. Les posologies proposées sont pour le flurbiprofène, un comprimé de 50 mg deux fois par jour, la dernière dose étant donnée 24 heures avant l’intervention. Pour les héparines de bas poids moléculaire (HBPM), en l’absence d’insuffisance rénale, on choisira deux injections par jour à dose curative. Après discussion collégiale avec le prescripteur de l’AAP, le patient doit être informé des modalités et des risques de modifications de son traitement.
Blocs Périphériques
Pour l’anesthésie locorégionale (ALR) des membres, le risque hémorragique lié aux AAP n’est pas documenté dans la littérature. L’aspirine et les AINS constituent probablement un risque très faible ou nul. Le risque lié aux thiénopyridines est ressenti comme plus important.
Concernant l’anesthésie régionale en ophtalmologie, il ne paraît ni justifié ni nécessaire d’interrompre un traitement par aspirine ou AINS avant une ALR en ophtalmologie. À l’opposé, un traitement par thiénopyridine est préférentiellement suspendu.
Dans le cadre de la chirurgie carotidienne, quelle que soit la technique anesthésique, l’arrêt de l’aspirine n’est pas souhaitable. Un traitement par thiénopyridines est habituellement interrompu avant la réalisation d’un bloc du plexus cervical profond. Si un tel traitement a été maintenu, il semble préférable de réaliser un bloc du plexus cervical superficiel, complété au besoin par une anesthésie locale chirurgicale.
Bloc Médullaire
Le risque d’hématome périmédullaire chez un patient traité par l’aspirine ou les AINS semble très faible. Il est préférable de séparer l’aspirine et les AINS des autres AAP (ticlopidine, clopidogrel), dont l’utilisation est beaucoup moins répandue et qui induiraient un surcroît de risque hémorragique. L’anesthésie rachidienne est déconseillée avec ces agents.
L’aspirine et les AINS ne contre-indiquent pas une ALR au cas par cas, si l’on considère que son bénéfice est supérieur au très faible risque d’hématome médullaire, à la condition :
- que le patient n’ait reçu aucun traitement anticoagulant avant la ponction ;
- de préférer la rachianesthésie « en ponction unique » à la péridurale ou à la rachianesthésie (rachi continue) avec cathéter ;
- qu’il n’existe pas d’anomalie associée de l’hémostase (importance de l’interrogatoire) ;
- que la surveillance neurologique postopératoire soit rigoureuse.
Anti-Vitamines K
Leurs principales indications sont la fibrillation auriculaire (AC/FA), la présence d’une valve cardiaque mécanique et la pathologie thromboembolique artérielle ou veineuse. La décision d’interrompre ou non le traitement se base sur le rapport entre les risques thromboembolique et hémorragique. En l’absence de traitement, le risque de récidive d’une embolie systémique chez les patients souffrant d’une AC/FA varie entre 5 et 20 % selon les facteurs de risque associés. Le risque de thrombose est de 8 % par an chez un patient porteur d’une valve mécanique. Un relais pré- et postopératoire par de l’héparine calcique sous-cutanée permet de limiter la période sans couverture antithrombotique. L’intervention a lieu lorsque l’International Normalized Ratio (INR) est inférieur à 1,5 et à distance de la dernière injection d’héparine lorsque le TCA s’est normalisé. Les AVK sont repris en période postopératoire. La place des héparines de bas poids moléculaire dans cette stratégie de substitution aux AVK reste à définir.
Médicaments du Système Nerveux Central
Antidépresseurs
La dépression est un désordre affectif pouvant intéresser jusqu’à 5 % de la population. Les antidépresseurs tricycliques ont été les principales molécules proposées dans cette indication au cours des 30 dernières années. Ils sont actuellement remplacés par les inhibiteurs de la recapture de la sérotonine.
Antidépresseurs Tricycliques
Les antidépresseurs tricycliques (ADT) inhibent la recapture présynaptique de la noradrénaline et de la sérotonine et facilitent leur libération. Ils potentialisent l’effet des catécholamines. La durée de leur effet se prolonge une semaine après leur arrêt. Ils sont impliqués dans la survenue de troubles du rythme. En anesthésie, l’association des imipraminiques avec des agents pro-arythmiques comme l’halothane et le pancuronium majore le risque. Les ADT allongent la durée de l’intervalle QT incitant à surveiller la kaliémie et à utiliser avec prudence les anti-arythmiques.
La longue durée d’action de ces molécules et la connaissance des interactions médicamenteuses conduit habituellement à ne pas interrompre le traitement par ADT. La conduite de l’anesthésie nécessite donc certaines précautions :
- Éviter les molécules pro-arythmiques (l’halothane, ce qui ne pose pas de problème chez l’adulte en France ; la bupivacaïne).
- Éviter les molécules à effet sympathomimétique (kétamine, éphédrine, anesthésiques locaux adrénalinés).
- Éviter les molécules à effet anticholinergique (pancuronium, atropine).
Inhibiteur de la Recapture de la Sérotonine et de la Noradrénaline
Deux molécules associent une inhibition de la recapture de la sérotonine et de la noradrénaline : la vinlafaxine (Effexor®) et la milnacipran (Ixel®). Elles présentent un risque d’hypertension et de tachycardie paroxystique lors de l’administration de vasopresseurs qui sont normalement contre-indiqués. Il existe une forme retard de la vinlafaxine. Ces deux molécules doivent selon ces données être arrêtées avant une anesthésie, surtout si le recours à des vasopresseurs est prévisible.
Inhibiteurs de la Monoamine Oxydase
La monoamine oxydase (IMAO) est une enzyme qui inhibe le catabolisme de la noradrénaline, de la dopamine et de la sérotonine. Cette inhibition est irréversible pour les IMAO d’ancienne génération (iproniazide) et trois semaines sont nécessaires pour la synthèse de novo de cette enzyme. Pour les nouveaux IMAO (toloxatone, moclobémide), l’inhibition est réversible 48 heures après l’arrêt du traitement. Ces derniers sont dépourvus d’effets anticholinergiques et n’ont pas de toxicité cardiaque propre.
Deux importantes interactions entre les agents utilisés en anesthésie et les IMAO justifient et imposent une adaptation dans la prise en charge péri-opératoire :
- L’utilisation des sympathomimétiques indirects (éphédrine) peut entraîner une libération massive de noradrénaline pouvant être fatale.
- L’utilisation de la mépéridine peut provoquer un syndrome d’hyperactivité sérotoninergique caractérisé par un état d’agitation, une instabilité hémodynamique, une hyperthermie, des céphalées, des convulsions pouvant entraîner le décès du patient.
Les IMAO de nouvelles générations ont simplifié grandement la conduite à tenir, puisqu’il suffit de les interrompre 24 à 48 heures avant l’intervention pour éviter toute interférence médicamenteuse. Il convient de contacter le médecin psychiatre en charge du patient.
Concernant les IMAO d’ancienne génération (iproniazide), l’attitude est encore débattue. Cette controverse a pour origine les situations où l’urgence chirurgicale a imposé une anesthésie sous IMAO qui s’est finalement déroulée sans complication. Certains, considérant le risque suicidaire majeur, préfèrent maintenir le traitement en retirant de la pharmacopée anesthésique les produits réputés dangereux. Une alternative élégante est de pratiquer un relais avec les IMAO de courte durée d’action et ce toujours en accord avec le médecin psychiatre en charge du patient. Enfin, le risque d’hypotension et les effets adverses des sympathomimétiques vasoconstricteurs conduisent à beaucoup de prudence si une anesthésie médullaire est nécessaire.
Inhibiteurs de la Recapture de la Sérotonine
Ce sont des inhibiteurs spécifiques de la recapture présynaptique de la sérotonine et ils ne présentent pas les inconvénients des ADT ou des IMAO. Le traitement ne doit pas être interrompu puisqu’un syndrome de sevrage peut apparaître, caractérisé par de l’anxiété, une agitation et des sueurs. Il est préconisé de vérifier l’ionogramme plasmatique pour rechercher un possible SiADH fréquent chez les personnes âgées. L’inhibition du métabolisme du midazolam (inhibition du cytochrome P450) peut prolonger son effet et son utilisation doit être prudente. La mépéridine peut en théorie favoriser un syndrome d’hyperactivité sérotoninergique (cf. IMAO).
Lithium
Les sels de lithium sont utilisés dans la psychose maniaco-dépressive. Ils diminuent la libération des neurotransmetteurs (compétition sodique). Le traitement par lithium justifie une étroite surveillance des patients compte tenu des très nombreux effets indésirables. Les signes cliniques (prodromes) de surdosage doivent être connus (céphalée, vomissements, diarrhées, soif, asthénie intense, vertiges, tremblements amples, dysarthrie) et la lithémie préopératoire doit être vérifiée. La lithémie efficace se situe entre 0,7 et 1 mmol·L⁻¹. Le surdosage est manifeste au-dessus de 1,5 mmol·L⁻¹. La perte de sodium est à éviter (régime sans sel, diurétique). Les interactions avec les médicaments de l’anesthésie se résument à une potentialisation des myorelaxants par réduction des récepteurs à l’acétylcholine. Cet effet n’a pas été retrouvé par d’autres auteurs. Lorsque les myorelaxants sont utilisés, le monitorage neuromusculaire est impératif. Les anti-inflammatoires non stéroïdiens augmentent la lithémie et sont à éviter. Les apports hydrosodés doivent faire l’objet d’une attention particulière et être parfaitement adaptés aux pertes.
Bien que toujours débattu, l’arrêt du traitement n’est plus la règle dès lors que les précautions mentionnées sont respectées.
Neuroleptiques
Les neuroleptiques bloquent les systèmes dopaminergiques centraux. Ils possèdent des effets anticholinergiques, antisérotoninergiques α-adrénolytiques périphériques. Ce sont des molécules antipsychotiques habituellement poursuivies jusqu’à l’intervention. On doit toujours garder à l’esprit :
- Le risque de syndrome malin des neuroleptiques.
- Les effets pro-arythmiques (allongement du QT).
- L’hypotension artérielle.
Antiparkinsoniens
La dopathérapie (L-dopa), associée ou non à un dopaminergique majeur (bromocriptine), est réservée aux formes invalidantes de la maladie de Parkinson. Elle ne doit pas être interrompue compte tenu du risque de réapparition d’un syndrome extrapyramidal et surtout de développer un équivalent du syndrome malin des neuroleptiques. Des auteurs rapportent l’administration entérale et même parentérale de L-dopa avec succès, pendant et après une intervention chirurgicale.
L’association à un inhibiteur de la décarboxylase périphérique (Modopar®, Sinemet®) permet de diminuer les effets secondaires périphériques dopaminergiques (hémodynamique, trouble du rythme). Il faut éviter l’halothane et le pancuronium ce qui, en pratique, ne pose pas de problème. Les neuroleptiques, qui antagonisent les effets antiparkinsoniens de la L-dopa, et la vitamine B6, coenzyme de la L-dopa décarboxylase périphérique, sont à éviter. Les agonistes dopaminergiques (bromocriptine) sont habituellement interrompus le matin de l’intervention.
Antiépileptiques
Les antiépileptiques ont fait l’objet d’une revue française récente. Les anticonvulsivants sont principalement des inducteurs enzymatiques augmentant les besoins en agents anesthésiques. Seuls la kétamine et l’étomidate sont à éviter.
Anorexigènes
Les anorexigènes ont tous des structures dérivées des amphétamines ou des sympathomimétiques. Leurs effets indésirables (troubles du rythme et accès hypertensifs) sont directement liés à leurs propriétés. Ils doivent être interrompus avant toute intervention chirurgicale en tenant compte de leur durée d’action. Des cas cliniques sans incident ont néanmoins été rapportés dans la littérature.
Traitement des Dyslipidémies
Les fibrates et les inhibiteurs de l’HMG-CoA réductase ou statines exposent au risque de myopathie et de rhabdomyolyse. Bien qu’aucun cas n’ait été rapporté, ils peuvent majorer une atteinte musculaire péri-opératoire. Le bénéfice thérapeutique à court terme n’étant pas majeur, il est conseillé d’interrompre le traitement la veille de l’acte opératoire.
Antidiabétiques Oraux
La prise en charge péri-opératoire des patients diabétiques a fait l’objet d’une revue récente par une équipe française. De très nombreux antidiabétiques oraux sont proposés aux patients et sont souvent utilisés en association. Le diabète doit être contrôlé avant une anesthésie et la glycémie surveillée et équilibrée pendant la période péri-opératoire. Pour les interventions mineures et de courte durée, les antidiabétiques oraux sont maintenus le matin de l’intervention à l’exception des biguanides (Stagid®, Glucophage®) qui doivent être arrêtés 48 heures avant, en raison du risque d’acidose lactique. Pour les interventions lourdes et/ou lorsque le diabète est déséquilibré, un relais par insuline est nécessaire.
Corticothérapie au Long Cours ou à Visée Anti-inflammatoire et/ou Immunosuppresseur
La corticothérapie au long cours ne doit jamais être suspendue brutalement. Cette règle élémentaire n’échappe pas à la période péri-opératoire. Le stress chirurgical augmente les besoins en cortisol alors que la réponse de l’axe surrénalien peut faire défaut. La démarche consiste à assurer une cortisolémie adaptée à la situation.
Les patients traités au long cours par une posologie n’excédant pas 5 mg de prednisone (Cortancyl®) maintiennent un axe surrénalien fonctionnel. Lorsque ces patients sont adressés pour un geste chirurgical mineur, le simple maintien du traitement jusqu’au matin de l’intervention est suffisant.
Dans les autres situations, il faut prescrire le traitement habituel et renforcer la corticothérapie par de l’hydrocortisone injectable pendant la période péri-opératoire. L’équivalent de 25 à 50 mg d’hydrocortisone sera administré à l’induction. Pour une chirurgie modérée ou sévère, le patient recevra en plus une dose quotidienne de 100 à 200 mg, le nombre de jours dépendant des suites chirurgicales, avant de revenir à la posologie habituelle.
Contraception Orale
Avec les « pilules » même minidosées (30 µg d’œstrogène), le risque thromboembolique dans la période péri-opératoire est augmenté. Il est conseillé d’interrompre la contraception orale 4 semaines avant une chirurgie à haut risque thromboembolique et pendant la période d’immobilisation postopératoire.
Traitement Hormonal Substitutif
Le risque médical d’interruption du traitement est mineur comparé au risque thromboembolique veineux. Il est donc prudent d’adopter les mêmes précautions que celles proposées pour les contraceptifs oraux.
Antirétroviraux
La suspension, même courte du traitement, peut induire rapidement une immunodépression importante et une augmentation de la charge virale. Lorsque pour des raisons chirurgicales, l’interruption du traitement ne peut être évitée, celle-ci doit être la plus courte possible et intéresser l’ensemble des médicaments antirétroviraux. En effet, le maintien d’une seule molécule peut entraîner des résistances. Sur le plan pharmacologique, les antiprotéases inhibent des isoenzymes du cytochrome P450, et interfèrent avec la plupart des agents anesthésiques. Les inhibiteurs de la transcriptase inverse présentent peu d’interactions en dehors de la zidovudine dont le métabolisme hépatique comporte une glycoroconjugaison. Ces considérations ont fait l’objet d’une conférence d’actualisation récente. L’attitude adoptée est donc de poursuivre le traitement jusqu’au matin de l’intervention et de le reprendre dès la reprise du transit, dans son intégralité. Il est fondamental de veiller à minimiser tous les facteurs susceptibles de retarder cette reprise.
Isoniazide
L’isoniazide (INH) est un antituberculeux majeur. Son métabolisme est hépatique. La première étape est une réaction d’acétylation, dont la vitesse est génétiquement déterminée. Les métabolites de l’acétyl-INH sont hépatotoxiques. L’apparition d’une hépatopathie est favorisée par l’association de l’INH à des inducteurs enzymatiques (cytochrome P450), une caractéristique de la plupart des produits utilisés en anesthésie. La règle est d’arrêter l’isoniazide 8 jours avant un geste chirurgical et de garder un intervalle de 15 jours précédant la reprise du traitement. Dans l’urgence, les halogénés, le thiopental et de façon générale tous les inducteurs enzymatiques sont proscrits.
Conclusion
La consultation d’anesthésiologie est indispensable mais n’exclut pas la visite préopératoire la veille de l’intervention, mais un délai parfois long s’écoulant entre ces deux actes.
Elle doit être bien conduite et dirigée pour prévenir les éventuels accidents anesthésiques.
Consultation d’Anesthésie – Anesthésiologie Dentaire
Voici une sélection de livres en français sur les prothèses dentaires:
- Prothèse Amovible Partielle : Clinique et Laboratoire
Collège National des Enseignants en Prothèses Odontologiques (CNEPO), Michel Ruquet, Bruno Tavernier - Traitements Prothétiques et Implantaires de l’Édenté Total 2.0
- Conception et Réalisation des Châssis en Prothèse Amovible Partielle
- Prothèses supra-implantaires: Données et conceptions actuelles
- Prothèse complète: Clinique et laboratoire Broché – Illustré, 12 octobre 2017
- Prothèse fixée, 2e Ed.: Approche clinique Relié – Illustré, 4 janvier 2024



[…] Dépression respiratoire : […]