Le biofilm bactérien (parodontologie)
Le biofilm bactérien (parodontologie)
Introduction
La bactérie est un micro-organisme unicellulaire qui peut exister sous deux formes principales :
- Planctonique : lorsqu’elle vit en flottaison libre dans un milieu liquide.
- Biofilm : lorsqu’elle se développe au sein d’une communauté microbienne.
Les bactéries peuvent passer d’un mode de vie à l’autre. Les surfaces dentaires, exposées à des colonisations microbiennes, forment une plaque bactérienne organisée en biofilm.
Définitions
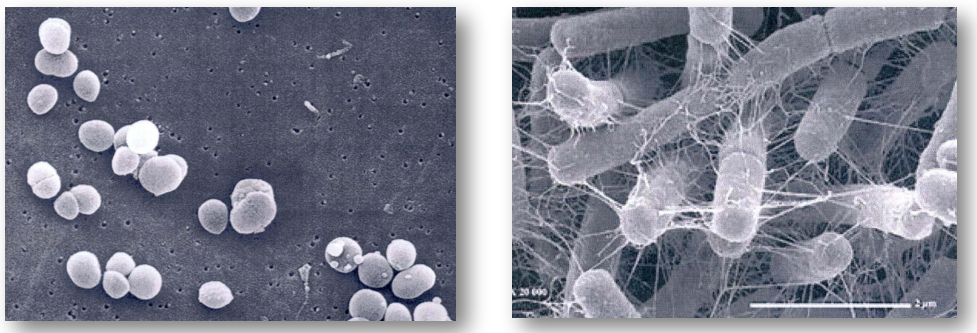
Selon Loe (1963)
Le biofilm est un dépôt mou, non calcifié, bactérien, qui se forme sur les dents insuffisamment nettoyées.
Selon Frank (1969)
C’est une jungle microbienne extrêmement polymorphe composée de bactéries aérobies et anaérobies, reliées par une matrice extracellulaire, accolées à la surface de la dent par la pellicule acquise, ainsi que des cellules épithéliales desquamées, des polynucléaires et des leucocytes.
Selon Glickman (1972)
C’est un dépôt granuleux, mou, amorphe qui s’accumule sur les faces des dents, sur les restaurations dentaires et sur le tartre. Il ne peut être détaché que par un nettoyage mécanique.
Selon Costerten
Le biofilm est une communauté multicellulaire, plus ou moins complexe, souvent symbiotique, de micro-organismes (bactéries, champignons, protozoaires) adhérant entre eux à une surface et marquée par la sécrétion d’une matrice adhésive et protectrice. Il se forme généralement dans l’eau ou en milieu aqueux.
Historique
- 1683 : Antonie van Leeuwenhoek observe des « animalcules » issus d’un échantillon de grattage de sa propre surface dentaire.
- 1889, 1900, 1930, 1978, 1996, 2002 : Périodes marquantes dans l’étude du biofilm, bien que les détails spécifiques ne soient pas précisés dans le document.
Classification
Le biofilm est classé selon plusieurs critères :
- Potentiel pathogénique : Cariogénique (lié aux caries) ou parodontogénique (lié aux maladies parodontales).
- Propriétés : Adhérent ou peu adhérent.
- Localisation par rapport au rebord gingival : Plaque supra-gingivale ou sous-gingivale.
Composition
Le biofilm est composé de :
- 80 % d’eau
- 20 % de matière organique :
- 20-30 % : Matrice inter-bactérienne.
- 70-80 % : Bactéries.
Composition bactériologique
Plaque supra-gingivale
Dans les 0 à 2 jours après la formation :
- 45 % : Coques Gram + (principalement Streptococcus).
- 25 % : Bâtonnets Gram + (anaérobies facultatifs ou obligatoires, comme Actinomyces).
- 20 % : Coques Gram -.
- 5 % : Bâtonnets Gram -.
Bactéries spécifiques
- Coques Gram + : Streptococcus sanguis, Streptococcus mitis, Streptococcus mutans, Staphylococcus epidermidis.
- Bacilles Gram + : Actinomyces viscosus, Bacterionema matruchotii, Rothia dentocariosa, Arachnia.
- Coques Gram – : Branhamella (ex-Neisseria), Veillonella (anaérobie).
- Bacilles Gram – : Bacteroides melaninogenicus (oralis), Corrodens, Capnocytophaga (ex-B. ochraceus), Fusobacterium, Leptotrichia, Selenomonas, Wolinella recta, quelques spirochètes près du sulcus.
Composition des matrices inter-bactériennes
Contenu organique
- Protéines : Issues du cytoplasme et de l’enveloppe des bactéries.
- Polysaccharides : Principalement des hydrates de carbone.
- Dextranes : 9,5 % de la matière solide de la plaque.
- Levanes : 4 %.
- Galactose : 2,4 %.
- Lipides : 15 %, incluant des produits extracellulaires, résidus cytoplasmiques, membranes cellulaires, aliments ingérés et dérivés des glycoprotéines salivaires.
Contenu inorganique
- Calcium : D’origine salivaire, sa forte présence indique une évolution vers la formation de tartre.
- Phosphore : Accumulé dans le biofilm, il a un effet anti-caries.
- Fluor : Présent sous trois formes (ions fluor libres, fluor ionisable, fluor fortement lié), provenant de l’émail, de la salive ou des aliments.
Formation
Un biofilm se forme en quelques heures à quelques jours, suivant ces étapes :
- Formation d’une pellicule initiale acquise sur les surfaces dentaires.
- Colonisation par des organismes bactériens spécifiques.
- Développement et maturation du biofilm.
- Détachement du biofilm.
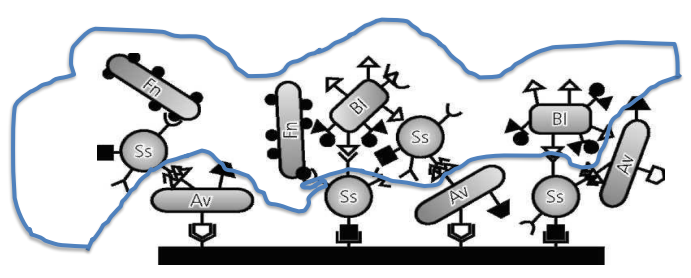
Formation de la pellicule acquise exogène (PAE)
Définition
La PAE est un film translucide, exogène, acellulaire, incolore, mou, réparti de façon diffuse sur la couronne, plus abondant près de la gencive. Son épaisseur varie de 0,05 à 0,8 micron, et elle apparaît spontanément dans les minutes suivant le brossage, principalement d’origine salivaire.
Composition
- Protéines salivaires : 98 % de glycoprotéines salivaires, incluant PRP (protéines riches en proline), mucines, IgA, IgG, histidine.
- Protéines plasmatiques : Albumine, fibrinogène, stathérines, cystatines.
- Protéines enzymatiques : Alpha-amylase, peroxydase, lysozyme, glycosyltransférases.
- Lipides.
- Hydrates de carbone : Galactose, mannose, glucose.
Rôles
Avantages
- Lubrification des surfaces dentaires.
- Barrière semi-perméable contre les attaques acides, prévenant la déminéralisation de l’émail.
- Régulation de l’équilibre minéral entre la salive et l’émail.
Inconvénients
- Modulation de l’adhérence bactérienne.
- Maintien des acides en contact avec l’émail, favorisant la colonisation bactérienne et la formation de la plaque dentaire.
Formation
- Adhésion instantanée de protéines salivaires spécifiques à l’émail, formant une sous-couche précurseur en 3 minutes.
- Fixation d’un second flot de protéines salivaires, atteignant une épaisseur initiale en 2 à 3 minutes, augmentant jusqu’à 1000 nm entre 30 et 90 minutes. La PAE est complète en 30 à 120 minutes.
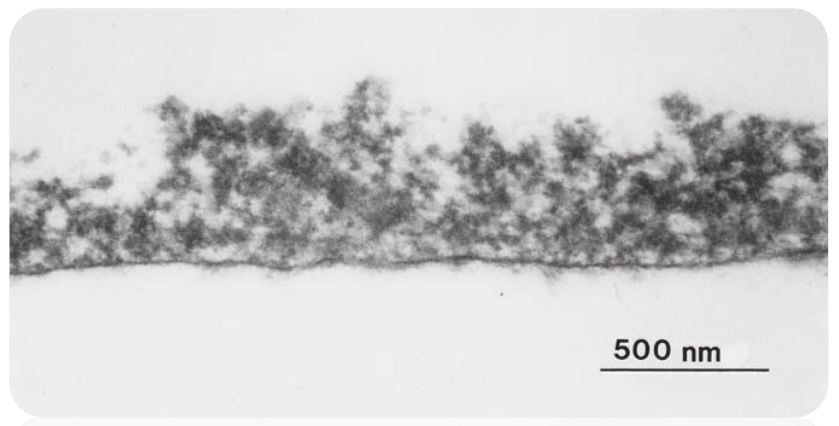
Colonisation par des organismes bactériens spécifiques
Certaines bactéries, équipées de structures comme le glycocalyx ou les fimbriae, s’attachent rapidement à la PAE. Les premières bactéries fixées (67 % coques Gram +) incluent majoritairement des streptocoques oraux, avec S. sanguinis prédominant. Ensuite, des bâtonnets Gram + (Actinomyces) et des bactéries anaérobies (Fusobacterium nucleatum, Prevotella intermedia) s’ajoutent, formant une communauté complexe.
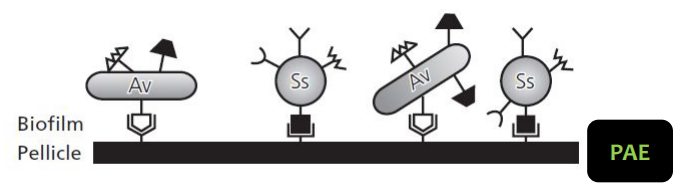
Adhérence et sélectivité de la colonisation
L’adhérence bactérienne suit deux phases :
- Phase réversible : Adhérence faible et temporaire.
- Phase irréversible : Consolidation de l’adhérence.
Mécanismes d’adhérence

L’adhérence se déroule en quatre étapes dynamiques :
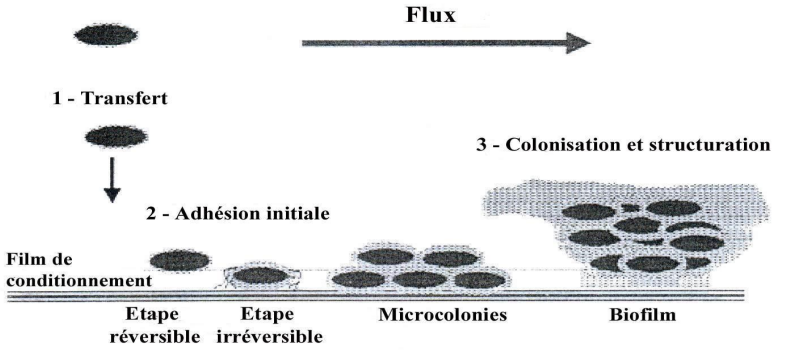
- Transport :
- Diffusion passive : Mouvement aléatoire des bactéries.
- Motilité : Mouvements propres via flagelles, parfois guidés par chimiotactisme.
- Convection : Mouvements induits par la langue et les flux salivaires.
- Interactions de longue distance (à 50 nm) :
- Forces de van der Waals : Attractives, faibles, diminuant avec la distance.
- Forces électrostatiques de répulsion : Dues aux charges négatives des bactéries et de la surface.
- Interactions de courte distance (à 1 nm, irréversibles) :
- Interactions acide-base : Formation de liaisons hydrogène.
- Interactions électrostatiques : Ponts via cations divalents (Ca²⁺, Mg²⁺).
- Interactions hydrophobes : Liaisons en milieu aqueux avec des molécules apolaires.
- Attachement :
- Adhésine-récepteur : Protéines bactériennes (adhésines) se fixant à des récepteurs saccharidiques de la PAE.
- Enzyme-substrat : Exemple avec S. mutans produisant des glycosyltransférases (GTF) formant des glycanes collants.
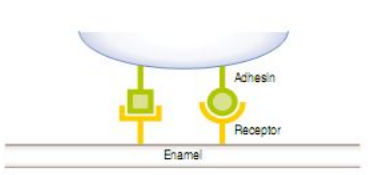
Différents types d’adhérence
- À la PAE : Stable, favorisant une communauté bactérienne multicouche. Les streptocoques (85 % des bactéries cultivables 4h après nettoyage) et Actinomyces dominent.
- Aux cellules épithéliales : Instable, monocouche, variable selon le site et le turn-over épithélial.
- Inter-bactérienne :
- Homotypique : Entre bactéries de même espèce.
- Hétérotypique : Entre espèces ou genres différents.

Médiateurs d’adhérence
- Fimbriae : Protéines filamenteuses, plus petites que les pili, permettant la colonisation des tissus durs (type I) ou épithéliaux (type II).

- Glycocalyx : Couche protectrice hydrophile d’exopolysaccharides ou glycoprotéines.
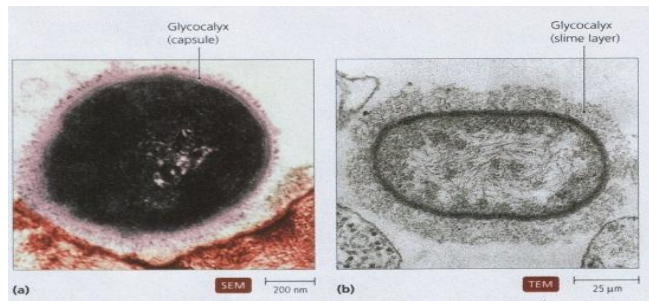
- Récepteurs : Protéines salivaires (glycoprotéines, agglutinines, PRP) spécifiques à certaines bactéries.
- Adhésines : Structures protéiques (pili, fimbriae, lectines) ou polysaccharidiques (glycocalyx, glucanes) fixant les bactéries aux surfaces ou entre elles.

- Coagrégation bactérienne : Fixation inter-bactérienne via molécules spécifiques, visible après quelques jours de maturation.
Développement et maturation du biofilm
La maturation repose sur :
- Prolifération bactérienne et développement de la matrice intercellulaire.
- Fraction cellulaire :
- Accroissement en nombre et volume : Confluence des microcolonies et saturation des sites de fixation.
- Diversité bactérienne : Recrutement de nouvelles espèces par adhérence inter-bactérienne hétérotypique.
- Apogée : Formation d’une communauté complexe et stable.
Détachement du biofilm
En cas de conditions défavorables, certaines bactéries (Aggregatibacter actinomycetemcomitans) secrètent des enzymes clivant leurs adhésines, permettant leur détachement pour coloniser d’autres sites. Un biofilm mature maintient une homéostasie microbienne, un équilibre entre les espèces.
Microbiologie
Complexes bactériens
La pathogénie parodontale est multifactorielle, hormis pour Aggregatibacter actinomycetemcomitans. Les complexes bactériens incluent :
- Complexe jaune : Streptococcus spp.
- Complexe vert : Capnocytophaga spp., Aggregatibacter actinomycetemcomitans (sérotype a), Eikenella corrodens, Campylobacter concisus.
- Complexe violet : Veillonella parvula, Actinomyces odontolyticus.
- Complexe orange : Campylobacter gracilis, Campylobacter rectus, Campylobacter showae, Eubacterium nodatum, Prevotella intermedia, Prevotella nigrescens, Peptostreptococcus micros, sous-espèces de Fusobacterium nucleatum.
- Complexe rouge : Porphyromonas gingivalis, Tannerella forsythensis, Treponema denticola.
- Complexe isolé : Aggregatibacter actinomycetemcomitans (sérotype b).
Les bactéries d’un même complexe sont souvent retrouvées ensemble, certaines sécrétant des facteurs de croissance pour d’autres. Des relations intercomplexes existent, notamment entre les complexes orange et rouge, et jaune et vert.
La composition du biofilm varie selon l’individu, l’état parodontal, les sites anatomiques et les conditions environnementales.
Biochimie
Rôle de l’alimentation
L’alimentation influence la formation du biofilm, bien que celui-ci puisse se former sans apport alimentaire oral. Elle modifie la quantité et la composition du biofilm :
- Alimentation dure et fibreuse : Entrave la formation en favorisant l’auto-nettoyage par la salive, les lèvres, les joues et la langue.
- Alimentation collante ou sucrée : Favorise la formation.
Une forte consommation de protéines et de sucres fermentescibles augmente les bactéries saccharolytiques et protéolytiques, leur nombre diminuant avec une restriction de ces apports.
Métabolismes bactériens
Les bactéries du biofilm métabolisent sucres et produits azotés pour leurs besoins cellulaires, rejetant des produits et déchets modifiant les conditions physico-chimiques du biofilm.
Métabolisme glucidique
- Substrats : Glucose, fructose, saccharose, issus de l’amidon, maltose, lactose ou dextranes. Les levanes fournissent du fructose.
- Processus : Une saccharase (invertase) est produite par Streptococcus mutans et S. sanguis. En anaérobiose, les sucres forment de l’acide lactique, abaissant le pH et augmentant le potentiel cariogène.
Métabolisme des acides aminés
- Source d’ammoniaque : Urée salivaire et fluide gingival.
- Activité uréase : Fournit des radicaux NH₃, augmentant le pH dans une plaque mature.
- Décarboxylations :
- Acide glutamique → Aminobutyrate (GABA).
- Ornithine → Putrescine.
- Lysine → Cadavérine.
- Histidine → Histamine.
- Globalement, ce métabolisme augmente le pH.
Métabolisme des acides nucléiques
- Dégradation : Par nucléases bactériennes (phosphodiestérase, ribonucléases, désoxyribonucléases), libérant pentoses-phosphates et bases puriques/pyrimidiques.
- Résultat : Formation d’urée, source d’ammoniaque, augmentant le pH.
Métabolisme des lipides
- Aérobiose : β-oxydation des acides gras alimentant le cycle de Krebs via acétyl-CoA.
- Anaérobiose : Cétogenèse produisant acide hydroxybutyrique et acétone, abaissant le pH.
Synthèse des incidences sur le pH
| Condition | Plaque | Métabolites | Produits du métabolisme | pH |
|---|---|---|---|---|
| Aérobiose | Jeune ouverte | Glucides, Lipides | Acides propionique, formique, butyrique, acétique | ↓ |
| Aérobiose | Jeune ouverte | Acides aminés, Acides nucléiques | Bioamines, ammoniaque, base purique et pyrimidique | ↑ |
| Anaérobiose | Mature, fermée, Bactéries des couches profondes | Glucides, Lipides | Acide lactique | ↓↓↓ |
| Anaérobiose | Mature, fermée, Bactéries des couches profondes | Acides aminés, Acides nucléiques | Bioamines, ammoniaque, base purique et pyrimidique | ↑ |
Conclusion
Le biofilm est l’acteur principal dans l’apparition et la progression des maladies parodontales, constituant le facteur étiologique déclenchant. Une connaissance approfondie de sa microbiologie est essentielle pour améliorer la prise en charge thérapeutique des maladies parodontales.
Le biofilm bactérien (parodontologie)
Voici une sélection de livres:
- Odontologie conservatrice et endodontie odontologie prothètique de Kazutoyo Yasukawa (2014) Broché
- Concepts cliniques en odontologie conservatrice
- L’endodontie de A à Z: Traitement et retraitement
- Guide clinique d’odontologie
- Guide d’odontologie pédiatrique, 3e édition: La clinique par la preuve
- La photographie en odontologie: Des bases fondamentales à la clinique : objectifs, matériel et conseils pratique

[…] membrane basale joue un rôle clé dans le renouvellement, la différenciation, le métabolisme et la défense de la […]